Принцип действия аккумулятора | Аккумуляторные батареи
Страница 3 из 26
1.4. Принцип действия аккумулятора
В настоящее время выпускаются следующие типы электрических аккумуляторов: свинцово-кислотные, щелочные железо-никелевые, кадмий-никелевые и серебряно-цинковые аккумуляторы.
Наиболее массовыми типами аккумуляторов являются свинцово-кислотные автомобильные батареи и тяговые щелочные железо-никелевые аккумуляторы. Серебряно-цинковые аккумуляторы находят ограниченное применение из-за дороговизны и дефицитности исходных материалов и сравнительно малого срока службы.
Кислотные аккумуляторы представляют собой сосуд, заполненный электролитом соответствующей плотности, т. е. раствором серной кислоты h3SO4 в дистиллированной воде, в который погружен блок пластин из чистого свинца РЬ и блок пластин из перекиси свинца РЬО2 (рис. 1.7). Вследствие постоянно происходящей диссоциации молекул кислоты в электролите заряженного аккумулятора имеются ионы водорода Н2 (катионы) и ионы кислотного остатка SO4 (анионы).
При разрядке кислотного аккумулятора происходят следующие химические реакции:
у отрицательной пластины
Pb + SO4 = PbS04;
у положительной пластины
РЬО2 + h3+h3SO4=PbSO4+2h3O.
Рис. 1.7. Устройство и принцип действия кислотного аккумулятора.
Из рассмотренных химических реакций видно, что при разрядке кислотных аккумуляторов на всех пластинах выделяется сернокислый свинец PbSO4 и уменьшается концентрация электролита (вследствие диссоциации кислоты и выделения воды).
Сернокислый свинец обладает двумя недостатками. Во-первых, при интенсивном образовании сернокислого свинца возможно коробление или выпучивание пластин, а также «высыпание» из пластин активной массы, так как объем сернокислого свинца больше объема исходных продуктов, из которых он образуется.
 Во-вторых, сернокислый свинец по истечении некоторого времени кристаллизуется в нерастворимое вещество. Часть пластины, которая оказалась покрытой кристаллизовавшимся сернокислым свинцом, не участвует в химических реакциях. Вследствие этого снижается полезная емкость аккумулятора. Такое явление носит название сульфатации кислотных аккумуляторов. Для того чтобы избежать явления сульфатации, кислотные аккумуляторы не следует хранить в незаряженном состоянии, нельзя допускать недозарядку аккумуляторов. При коротком замыкании в результате бурной химической реакции и интенсивного выделения сернокислого свинца происходит коробление пластин кислотного аккумулятора.
Во-вторых, сернокислый свинец по истечении некоторого времени кристаллизуется в нерастворимое вещество. Часть пластины, которая оказалась покрытой кристаллизовавшимся сернокислым свинцом, не участвует в химических реакциях. Вследствие этого снижается полезная емкость аккумулятора. Такое явление носит название сульфатации кислотных аккумуляторов. Для того чтобы избежать явления сульфатации, кислотные аккумуляторы не следует хранить в незаряженном состоянии, нельзя допускать недозарядку аккумуляторов. При коротком замыкании в результате бурной химической реакции и интенсивного выделения сернокислого свинца происходит коробление пластин кислотного аккумулятора.PbS04 + h3 = Pb + h3S04;
у положительной пластины
PbS04 + 2 Н20 + S04 = Рb02 + 2 Н2 + 2 h3SO4.
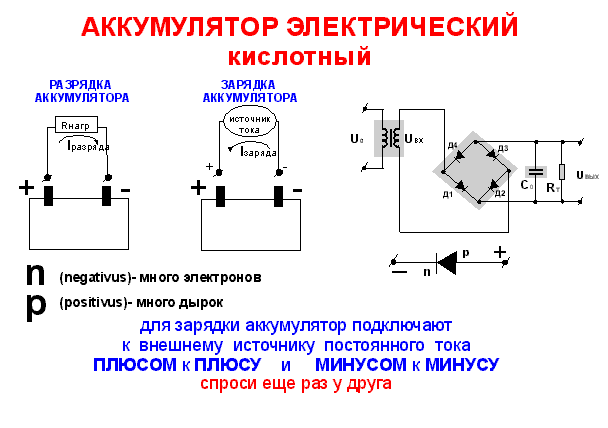
Следовательно, при зарядке аккумуляторов происходит разложение сернокислого свинца на исходные продукты, а также восстановление концентрации электролита. Очевидно, что окончанием зарядки аккумуляторов можно считать такой момент, когда весь сернокислый свинец разложился и концентрация электролита восстановилась до нормальной. При дальнейшей зарядке потребляемая аккумулятором электрическая энергия будет расходоваться на разложение воды, имеющейся в электролите. Вода разлагается на водород и кислород. Кислород, как наиболее активный газ, производит окисление металлов, имеющихся в аккумуляторе. Водород выделяется в атмосферу. Поэтому на поверхности электролита появляются пузырьки, создающие впечатление «кипения» электролита. В смеси с воздухом водород образует взрывчатый гремучий газ, который должен быть немедленно удален из аккумуляторного помещения.

Напряжение, создаваемое аккумулятором на зажимах, определяется уравнениями:
при разрядке
U = E-IPr;
при зарядке
U=E+Iзар r
где Е – ЭДС аккумулятора;
Ip,Iзар – соответственно ток разрядки и зарядки аккумулятора;
r – внутреннее сопротивление аккумулятора.
Кислотные аккумуляторы имеют небольшое внутреннее сопротивление, поэтому напряжение на зажимах аккумулятора незначительно снижается даже при больших токах нагрузки. В среднем сопротивление кислотного аккумулятора составляет 0,005 Ом и является величиной, зависящей от плотности электролита, а также от габаритов аккумуляторов (чем больше габариты, тем меньше сопротивление). С уменьшением плотности электролита, т. е. с увеличением степени разряда, ЭДС кислотных аккумуляторов уменьшается, а внутреннее сопротивление увеличивается. Вследствие этого напряжение аккумулятора в начале разрядки понижается незначительно, а к концу падает быстро.
В настоящее время применяются в основном две разновидности щелочных аккумуляторов: кадмиево-никелевые и железо-никелевые.
Электролитом их является раствор едкого калия КОН в дистиллированной воде (плотность электролита 1,19—1,21). В качестве активной массы положительных пластин служит гидрат окиси никеля Ni(OH)3, а активной массы отрицательных – губчатый кадмий Cd (рис. 1.8).
Рис. 1.8. Устройство и принцип действия щелочного кадмиево-никелевого аккумулятора
При разрядке аккумулятора анионы щелочного остатка ОН стремятся к пластинам из чистого кадмия. Избыточные электроны кислотного остатка направляются во внешнюю цепь и к пластинам из гидрата окиси никеля, где они нейтрализуются катионами калия. Таким путем создается разрядный ток аккумулятора.
При разрядке щелочного аккумулятора происходят следующие химические реакции:
у отрицательной пластины
у положительной пластины
Ni (ОН)3 + К = Ni (OH)a + КОН.
Из данных реакций видно, что при разрядке щелочного аккумулятора кадмий переходит в гидроокись кадмия Cd(OH)2, а трехатомный гидрат окиси никеля Ni(OH)3 – в двухатомную гидроокись никеля Ni(ОН)2. Эти вещества не обладают отрицательными свойствами, поэтому щелочные аккумуляторы не требуют тщательного ухода в эксплуатации, могут быть длительно незаряженными, мало разрушаются при коротких замыканиях.
При зарядке щелочных аккумуляторов катионы калия движутся к отрицательным пластинам, а анионы щелочного остатка – к положительным. При зарядке происходят следующие химические реакции:
Cd(OH)2 + 2K = 2KOH+Cd;
у положительной пластины
Ni(OH)2 + OH = Ni(OH)3.
При разрядке, и при зарядке щелочных аккумуляторов плотность электролита остается постоянной, так как диссоциация едкого калия на ионы К и ОН компенсируется образованием КОН.
После переработки всех веществ, участвующих в химических реакциях, при зарядке щелочных аккумуляторов происходит разложение воды электролита и «кипение» аккумулятора.

Электрический аккумулятор. Строение и принцип работы.
Электри́ческий аккумуля́тор — химический источник тока многоразового действия, основная специфика которого заключается в обратимости внутренних химических процессов, что обеспечивает его многократное циклическое использование (через заряд-разряд) для накопления энергии и автономного электропитания различных электротехнических устройств и оборудования.
Принцип действия аккумулятора основан на обратимости химической реакции. Работоспособность аккумулятора может быть восстановлена путём заряда, то есть пропусканием электрического тока в направлении, обратном направлению тока при разряде.
Несколько аккумуляторов, объединенных в одну электрическую цепь, составляют аккумуля́торную батаре́ю.
Для того чтобы ясно понять суть работы электрических аккумуляторов, давайте разберёмся с его устройством и общим принципом действия. И так — в основу работы всех химических источников электропитания заложены две составляющие: это пара электродов и электролит.
Электрический ток — это упорядоченное движение заряженных частиц (в твёрдых веществах, это электроны, а в жидких и газообразных, это ионы). Ток не может существовать без воздействия электродвижущей силы Э.Д.С. (разности потенциалов или напряжения). Значит, между электродами что-то должно создавать эту Э.Д.С. А создаёт её следующий процесс!
И так, у нас имеется сосуд с двумя электродами, погружённых в жидкий электролит. С точки зрения химии, в этом сосуде происходит растворение одного электрода (под действием кислотной или щелочной среды электролита) и восстановление (отложение слоя) другого. При этом от растворяющегося электрода (металла) отрываются ионы этого вещества, которые с собой уносят положительный заряд. А электроны, ранее принадлежащие этому атому металла и не имеющие возможности уйти с ним, остаются на этом электроде.
На другом же электроде будет происходить противоположный процесс, те ионы, которые были оторваны от первого, переходят на второй, неся в себе положительный заряд и постоянно прибавляя его к электроду. Весь этот химический процесс окислительно-восстановительной реакции сопровождается превращением одних веществ в другие, при заряде, и взаимообратный, при разряде электрического аккумулятора.
Весь этот химический процесс окислительно-восстановительной реакции сопровождается превращением одних веществ в другие, при заряде, и взаимообратный, при разряде электрического аккумулятора.
В итоге получается, что под воздействием внешнего источника электрического поля (в случае процесса заряда) мы принудительно превращаем одни вещества в другие, а при подключении к клеммам электрической нагрузки (создавая тем самым замкнутую цепь), мы позволяем накопленной электроэнергии выйти, по средствам обратного химического превращения веществ. Следует заметить, что электролит в этой электрохимической системе является переносчиком положительного заряда (ионов, оторванных от электрода), и они перемещаются внутри самого аккумулятора. А отрицательный заряд (то есть электроны) будет транспортироваться по внешней цепи, вне аккумулятора.
Принцип работы зарядного устройства
Принцип работы зарядного устройства
Классическое
зарядное устройство состоит из трансформатора и выпрямителя. Вырабатывает оно
постоянный ток с напряжением 14,4V. Почему используется именно этот показатель
напряжения, а не 12V, которые имеет батарея?
Вырабатывает оно
постоянный ток с напряжением 14,4V. Почему используется именно этот показатель
напряжения, а не 12V, которые имеет батарея?
Такой показатель выбран, чтобы электрический ток мог пройти через разряженный автомобильный аккумулятор. Если аккумулятор разряжен не до нуля, то напряжение на нем составляет 12V или очень близко к этому показателю. Такую аккумуляторную батарею практически невозможно подзарядить устройством, которое на выходе имеет также 12V. Поэтому напряжение на выходе зарядных устройств нужно сделать больше, оптимальным стала величина именно 14,4V.
Следует отметить, что очень сильное завышение зарядного напряжения пагубно влияет на срок службы любой аккумуляторной батареи, и она уже через пару лет может полностью выйти из строя.
Как только вы подсоединили зарядное устройство к батарее и включили его в сеть, то начинается процесс восстановления емкости.
В процессе зарядки аккумулятора меняется его внутреннее сопротивление (оно
растет) и зарядный ток снижается. Когда напряжение на аккумуляторной батарее
приближается к отметке 12V,
ток приближается к
нулю. Это свидетельствует о том, что зарядка прошла успешно и устройство можно
отключать.
Когда напряжение на аккумуляторной батарее
приближается к отметке 12V,
ток приближается к
нулю. Это свидетельствует о том, что зарядка прошла успешно и устройство можно
отключать.
C учетом технологических особенностей аккумуляторов их принято заряжать током величиной 10% от емкости. Например, если аккумулятор имеет емкость 90 Ач, то оптимальный зарядный ток находится в пределах 9А, а время подзарядки будет составлять около 10 часов.
Для экстренной ускоренной зарядки можно повысить ток и сократить время заряда на несколько часов или даже в несколько раз. Но это довольно опасно и крайне отрицательно влияет на работу аккумулятора. При стремительном заряде также нужно следить за температурой электролита. Если температура выросла больше 45С, то срочно нужно снизить зарядный ток.
Как правило,
для регулировки параметров заряда на устройствах имеются специальные
регуляторы. Если вы не знаете, что и куда крутить, то изучите инструкцию, там
подробно должно быть написано как правильно пользоваться прибором, во избежание
неприятностей и травм при зарядке.
Назначение и принцип работы
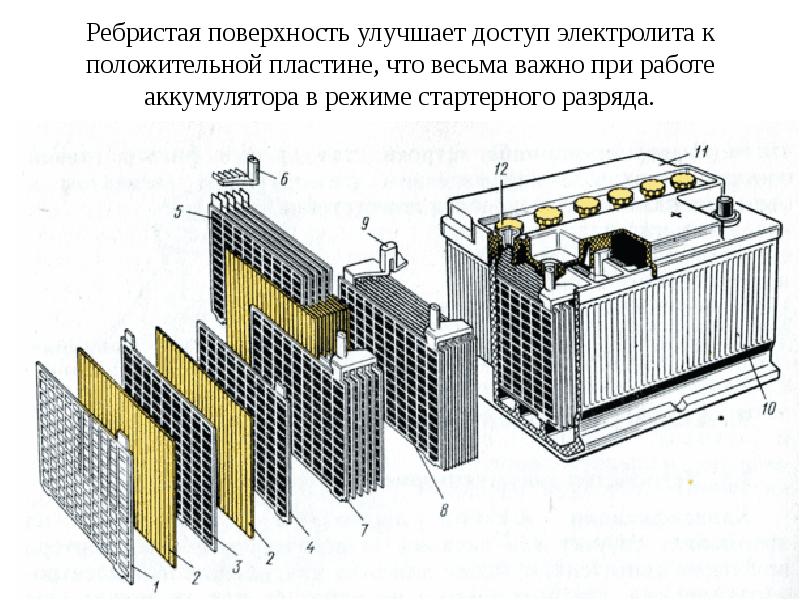
Аккумуляторные батареи тепловозов предназначены для питания током тяговых генераторов или стартер-генераторов при пуске дизелей, питания цепей управления и освещения при неработающем дизеле. Аккумуляторная батарея состоит из последовательно соединенных элементов, работа которых основана на способности электрической энергии преобразовываться в химическую и, наоборот, способности химической энергии преобразовываться в электрическую. На тепловозах применяют кислотные (свинцовые) и щелочные (никель-железные и никель-кадмиевые) аккумуляторы, отличающиеся друг от друга материалом пластин и составом электролита.
Простейший кислотный аккумулятор представляет собой сосуд с водным раствором серной кислоты (электролитом), в который погружены два электрода (свинцовые пластины). В кислотных аккумуляторах активной массой положительных пластин служит перекись (двуокись) свинца (РЬО_>) темно-коричневого цвета, а отрицательных — губчатый (чистый) свинец (РЬ) серого цвета. При разрядке ток внутри элемента протекает от отрицательной пластины к положительной, активная масса переходит в сернокислый свинец, на что расходуется серная кислота, взамен которой образуется вода, плотность электролита понижается.
При разрядке ток внутри элемента протекает от отрицательной пластины к положительной, активная масса переходит в сернокислый свинец, на что расходуется серная кислота, взамен которой образуется вода, плотность электролита понижается.
Во время заряда ток от внешнего источника подводится к положительной пластине и проходит по электролиту к отрицательной пластине. Сернокислый свинец на отрицательной пластине восстанавливается в губчатый свинец, а на положительной пластине превращается в двуокись свинца. При этом образуется серная кислота, а так как на ее образование расходуется вода, то плотность электролита повышается.
Аккумулятор после заряда приходит в то же состояние, в каком он находился до разряда.
Напряжение и э.д.с. кислотного аккумуляторного элемента независимо от размеров аккумулятора при нормальной плотности электролита и средней температуре составляют 2-2,1 В; с увеличением плотности электролита э.д.с. элемента возрастает. Если внешняя цепь разомкнута, то э. д.с. и напряжение аккумулятора равны.
д.с. и напряжение аккумулятора равны.
Аккумулятор, как и любой другой источник электрической энергии, обладает внутренним сопротивлением 1?Вн, поэтому напряжение U, подведенное к аккумулятору при заряде, больше э.д.с. аккумулятора Е:
У = £+//?,.,.
При разряде напряжение на зажимах аккумулятора меньше его э.д.с. на значение внутреннего паления напряжения:
U = E-IRm.
Во время заряда напряжение аккумулятора изменяется. Вначале напряжение элемента почти не изменяется, а к копну заряда (примерно через 3,5 ч) поднимается до 2,6 2,7 В, при этом около пластин интенсивно выделяются газы (электролит кипит). После отключения аккумулятора от источника тока напряжение элемента быстро снижается до 2,1 2,2 В. Во время разряда напряжение аккумулятора быстро падает до 2 В, а затем медленно уменьшается до 1,8 В. Нел и продолжать разряд дальше, то напряжение начнет резко падать. Чтобы избежать повреждения аккумулятора, при напряжении 1,7 В разряд прекращают.
Емкостью аккумулятора называется количество электричества, которое можно получить от полностью заряженного аккумулятора при разряде до минимально допустимого напряжения на зажимах. Емкость аккумулятора равна произведению разрядного тока на вре мя разряда и выражается в ампер-часах (А-ч).
Емкость аккумулятора равна произведению разрядного тока на вре мя разряда и выражается в ампер-часах (А-ч).
Емкость аккумулятора зависит от количества и пористости активной массы пластин (размера и толщины), плотности (концентра чип) и температуры электролита и значения разрядного тока.
Количество электричества и энергии, которое отдает в пень аккумулятор при разряде, всегда меньше, чем полученные им при заряде. Величины, характеризующие степень использования количества электричества и энергии (выраженные в процентах), называются отдачей аккумулятора. Значение, показывающее степень использования количества электричества, называется ампер-часовой отдачей, а показывающее использование энергии ■-ватт-часовой отдачей, или к.п.д. аккумулятора. Для кислотных аккумуляторов ампер-часовая отдача равна 80- 85%, а для щелочных — 60 70%.
При работе аккумуляторов и их храпении с электролитом происходит потеря емкости (на утечки тока, саморастворение электродов и др.), которая называется саморазрядом аккумулятора.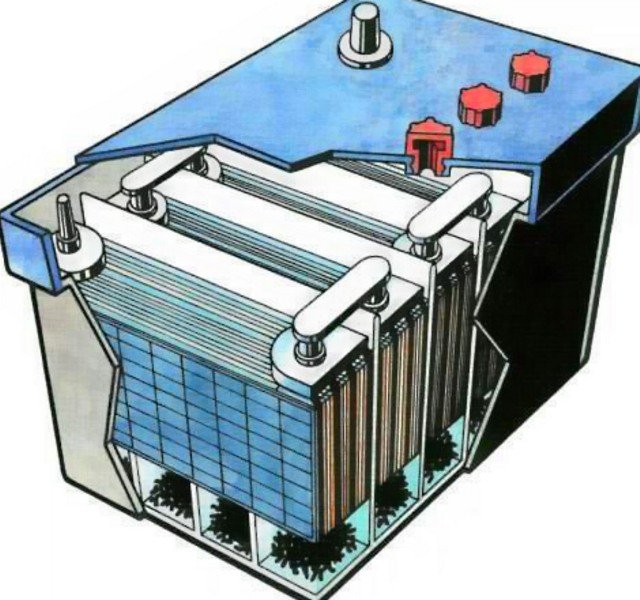
Щелочные аккумуляторы применяются двух типов: никель-железные и никель-кадмиевые. Активная масса положительных пластин в этих аккумуляторах состоит из окисла никеля, смешанного для увеличения электропроводности с графитом. Эта масса помещена в тонкие железные оболочки с мелкой перфорацией. Отрицательные пластины изготовлены из губчатого железа (никель-железные аккумуляторы) или из губчатого кадмия с добавлением губчатого железа, В качестве электролита используют раствор едкого кали в дистиллированной воде. При разряде аккумулятора окислы никеля в положительных пластинах переходят в гидрат окиси железа. Особенностью щелочных аккумуляторов является то, что концентрация раствора едкого кали при разряде остается неизменной. Поэтому напряжение щелочных аккумуляторов почти не зависит от плотности электролита и определяется степенью окисления активной массы. Во время заряда происходит обратный процесс: на положительных пластинах образуются окислы никеля, а на отрицательных восстанавливается губчатое железо.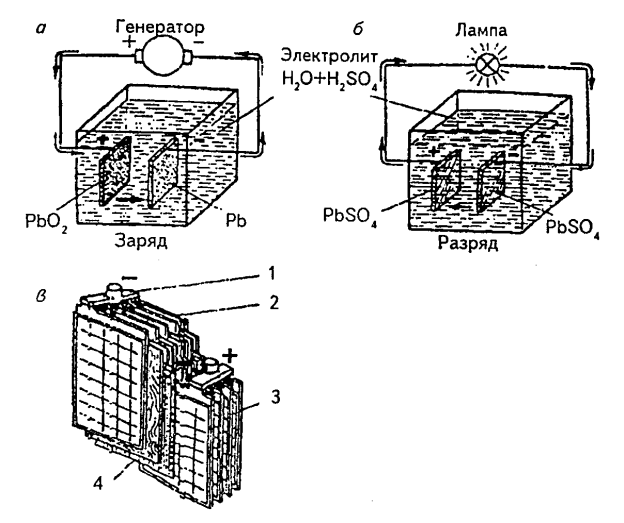
Полностью заряженный аккумулятор имеет э.д.с, равную примерному 1,45 В. Об окончании заряда щелочного аккумулятора судят по напряжению. После того как напряжение под нагрузкой достигнет 1,83 В, заряд продолжают еще в течение 30-40 мин, а затем прекращают. Длительность заряда составляет 6-7 ч. Вначале разряда напряжение довольно быстро падает до 1,3 В, затем медленно снижается до 1,1 В; при таком напряжении разряд следует прекратить, иначе напряжение начнет резко уменьшаться.
Щелочные аккумуляторы имеют ряд преимуществ перед кислотными: увеличенный срок службы (пять — семь лет вместо двух-трех), использование для изготовления менее дефицитных материалов, они медленнее, чем свинцовые, саморазряжаются (при этом не разрушаются пластины), имеют большую механическую прочность и малую чувствительность к перезаряду и недозаряду, а также к большим разрядным токам, требуют более простого обслуживания и ремонта.
⇐ | Испытания электрических машин | | Рудая К. И., Логинова Е. Ю. Тепловозы. Электрическое оборудование и схемы. Устройство и ремонт | | Устройство тепловозных аккумуляторных батарей | ⇒
Ю. Тепловозы. Электрическое оборудование и схемы. Устройство и ремонт | | Устройство тепловозных аккумуляторных батарей | ⇒
Устройство и принцип работы аккумулятора | Основы физики сжато и понятно
Пишу для школьников (для лучшего понимания ими основ физики). Материал излагаю в соответствии с признанной ныне научной трактовкой физических явлений. Критике существующей теории и глубоким теоретическим рассуждениям здесь не место.
Аккумуляторы, как и гальванические элементы, являются химическими источниками постоянного тока.
Но в отличие от гальванических элементов, образующиеся в аккумуляторах в результате реакций химические соединения, могут быть разложены и приведены в первоначальное состояние.
Иначе, в аккумуляторах возможны и обратные процессы — превращения электрической энергии в химическую.
Рассмотрим принцип работы аккумуляторов на примере свинцового аккумулятора, применяемого в автомобиле.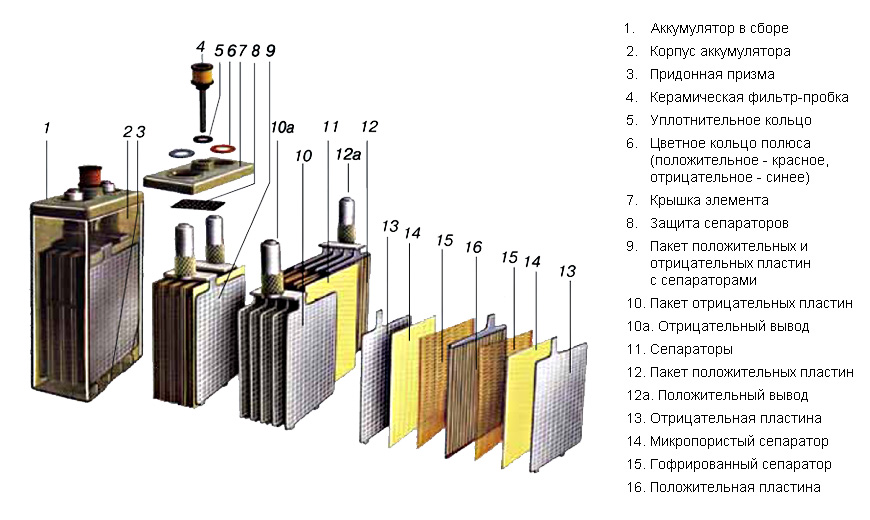
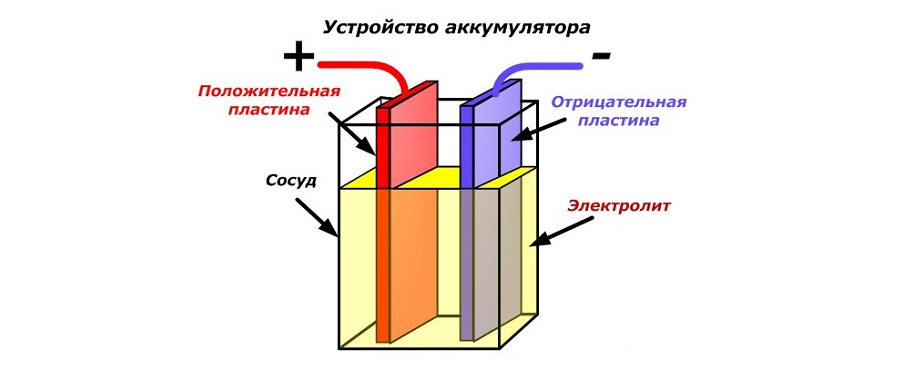
Свинцовый аккумулятор представляет собой сосуд, заполненный раствором серной кислоты (дистиллированной воды с небольшим количеством кислоты), в который помещены две пластинки — одна изготовлена из чистого свинца (губчатого свинца), другая — из диоксида свинца.
Чистый свинец является более активным веществом (быстрее растворяется в растворе кислоты). Из свинцовой пластинки в раствор выходят положительно заряженные ионы свинца, а пластинка заряжается отрицательно.
Электрод из диоксида свинца растворяется слабее. Молекулы диоксида свинца, соединяясь с молекулами воды, разделяются на положительные ионы четырёхвалентного свинца и отрицательные ионы ОН. Образовавшиеся ионы свинца осаждаются на пластинке, заряжая её положительно.
Между заряженными пластинками (электродами) возникает разность потенциалов, равная примерно 2 В.
Так как для работы приборов автомобиля требуется постоянное напряжение в 12 В, то в нём используется аккумуляторная батарея, состоящая из шести последовательно соединённых аккумуляторов — в обиходе её называют просто аккумулятором (хотя это батарея аккумуляторов).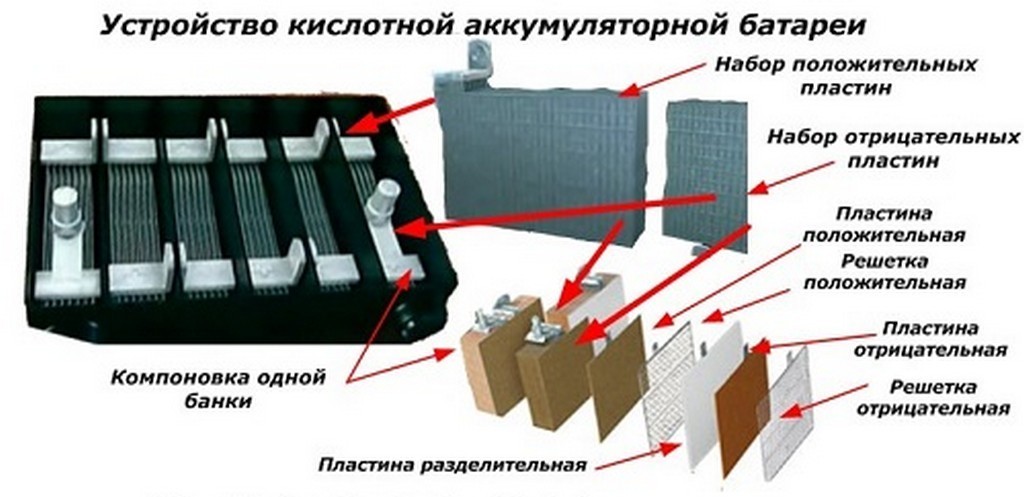
Особенностью аккумулятора является то, что он способен накапливать и удерживать значительную энергию в течение некоторого промежутка времени, а затем (при подключении к нагрузке) быстро отдавать эту энергию.
Так, аккумулятор в автомобиле способен отдать стартёру кратковременный ток в сотни ампер, запустив этим работу двигателя внутреннего сгорания автомобиля.
Отдав энергию, аккумулятор в какой — то степени разряжается, но во время хода автомобиля он и заряжается от генератора. Так что в процессе работы автомобиля аккумулятор находится в нормальном (заряженном) состоянии.
Но если автомобиль долго не эксплуатировался, то аккумулятор разряжается. Он разряжается и в том случае, если отключен от потребителя (внешняя цепь разомкнута), когда он, например, стоит на столе.
Рассмотрим процесс разряда аккумулятора.
При подключении аккумулятора к потребителю свободные электроны с катода пойдут во внешнюю цепь, анод же будет поглощать свободные электроны из внешней цепи — по цепи пойдёт разрядный ток.
Процесс разряда аккумулятора можно изобразить формулой, идя в ней слева направо:
В левой части формулы записаны вещества, которые были в аккумуляторе изначально. В правой части записаны вещества образовавшиеся в процессе реакции.
В результате взаимодействия пластин с серной кислотой образуется вода и сернокислый свинец, откладывающийся на обеих пластинках.
Чем больше на пластинках накапливается сернокислого свинца, плохо проводящего ток, тем больше аккумулятор разряжается.
Таким образом, при разряде аккумулятора расходуется серная кислота и образуется вода, то есть плотность электролита уменьшается. По плотности электролита можно судить о степени заряженности аккумулятора.
На следующем рисунке приведены кривые зависимости напряжения на зажимах аккумулятора от времени, поясняющие процесс заряда (кривая 1) и разряда (кривая 2) аккумулятора.
Сейчас речь идёт о разряде, поэтому обратим внимание на кривую 2. Понижение напряжения на зажимах аккумулятора при разряде объясняется уменьшением плотности электролита при разряде.
Понижение напряжения на зажимах аккумулятора при разряде объясняется уменьшением плотности электролита при разряде.
Здесь приведены данные для одного аккумулятора. Если говорить о батарее, состоящей из 6 аккумуляторов, то напряжение надо увеличить в 6 раз.
Согласно кривой 2, при разрядке напряжение на аккумулятора падает. Если напряжение упало до 1,8 В, значит пора его заряжать. Если аккумулятор продолжать эксплуатировать, то напряжение на нём быстро упадёт до нуля. Это будет означать, что вся запасённая в аккумуляторе энергия израсходована, его пластины покрылись толстым слоем сернокислого свинца.
Если в это время аккумулятор отключить от нагрузки и поставить на зарядку, то напряжение на нём может увеличиться до 2 В (из — за проникновения электролита внутрь пластин). Но при включении нагрузки напряжение вновь быстро снизится до нуля. Аккумулятор полностью вышел из стоя, и не стоит тратить время на его зарядку.
Аккумулятор характеризуется ёмкостью.
Под ёмкостью аккумулятора понимается энергия, которую он может передать нагрузке при разряде до допустимого предела. равного 1,8 В. Измеряется ёмкость ампер-часами.
Например, аккумулятор ёмкостью 55 А ч может давать ток силой 55 А в течение 1 часа. Ёмкость зависит от количества активной массы, соприкасающейся с электролитом, силы разрядного тока и температуры электролита. При увеличении силы разрядного тока и уменьшении температуры электролита ёмкость аккумулятора уменьшается.
Для увеличения ёмкости аккумулятора несколько одноимённо заряженных пластин соединяют параллельно.
Каждая группа таких заряженных пластин работает как одна большая пластина, площадь которой равна сумме их площадей. Число отрицательных пластин должно быть на одну больше, чем положительных, чтобы обе стороны положительных пластин вступали во взаимодействие с электролитом.
Теперь рассмотрим как происходит процесс зарядки аккумулятора.
Для зарядки аккумулятора его подключают к другому источнику постоянного напряжения плюсом к плюсу (одноимёнными полюсами).
При этом зарядный ток в аккумуляторе течёт в направлении обратном разрядному току (при разрядке аккумулятора).
И химический процесс при разряде аккумулятора тоже идёт в обратном направлении (теперь надо смотреть на уравнение химической реакции справа налево)
В правой части уравнения записано то, что получено при разрядке аккумулятора, а в левой части — то, что получается при зарядке аккумулятора.
Происходит следующее.
На отрицательном электроде анионы свинца, образованные из сульфата свинца, связываются с электронами, поступающими из внешней цепи, образуя чистый губчатый свинец.
На положительном электроде происходит образование окиси свинца с отдачей во внешнюю цепь электронов.
Количество воды в электролите уменьшается, количество кислоты растёт, то есть растёт плотность электролита. Таким образом, при заряде наряду с образованием на электродах исходных веществ (свинца и окиси свинца) повышается плотность электролита за счёт восстановления серной кислоты
По завершению процесса восстановления электродов, зарядка аккумулятора прекращается.
Если продолжать пропускать дальше зарядный ток через электролит, то начнётся процесс разложения воды на кислород и водород. Смесь этих газов взрывоопасна, поэтому следует избегать лишней продолжительности зарядки аккумулятора.
Итак, нами рассмотрен механизм преобразования химической энергии в электрическую энергию аккумулятора при его зарядке, и преобразования электрической энергии в химическую при разрядке аккумулятора.
Чтобы аккумулятор служил долго, не надо допускать его глубокой разрядки. При уменьшении напряжения на одном аккумуляторе до 1,8 В (на батарее аккумуляторов в 6 раз большем), аккумулятор надо заряжать. Величина зарядного тока не должна превышать 0,1 от ёмкости аккумулятора, то есть при ёмкости 55 А ч зарядный ток не должен быть больше 5,5 А. Продолжительность зарядки определяется стабилизацией тока на аккумуляторе.
Задача.
Аккумулятор подключен для зарядки к сети с напряжением 14 В. Внутреннее сопротивление аккумулятора 0,4 Ом. Какова электродвижущая сила ЭДС этого аккумулятора, если при зарядке через него проходит ток силой 5 А?
Аккумулятор при зарядке подключается так, как показано на рисунке. Зарядный ток в аккумуляторе должен идти в направлении обратном разрядному току (когда аккумулятор подключен к нагрузке)
Тогда напряжение стороннего источника постоянного тока минус ЭДС аккумулятора будет равно произведению силы разрядного тока на внутреннее сопротивление аккумулятора:
Отсюда ЭДС аккумулятора
Ответ: ЭДС аккумулятора равна 12 В.
К.В. Рулёва
Подписывайтесь на канал. Ставьте лайки. Пишите комментарии. Сообщите друзьям о существовании этого канала.
Предыдущая запись:Нахождение массы вещества, выделившегося на электродах
Следующая запись: Занятие 60. Электрический ток в газах.
Ссылки на занятия до электростатики даны в Занятии 1.
Ссылки на занятия (статьи), начиная с электростатики, даны в конце Занятия 45.
Ссылки на занятия (статьи), начиная с теплового действия тока, даны в конце Занятия 58.
Бак аккумулятор горячей воды: принцип работы — Бак аккумулятор тепла | аккумулирующая буферная ёмкость
Современные реалии диктуют свои условия, в том числе это относится и к отопительным системам. Стоимость энергоносителей растет, следовательно, все домовладельцы постоянно хотят усовершенствовать свое тепловое оборудование. Одним из таких способов является установка теплоаккумулятора.
Что такое бак теплоаккумулятор?
В сущности это резервуар для накапливания нагретой воды. Благодаря данному агрегату потребители смогут существенно уменьшить траты на отопление дома. Конструкция совершенно не сложная, поэтому многие умельцы делают его собственноручно. Принцип работы бака аккумулятора базируется на эксплуатировании высокой теплоёмкости воды. К примеру, один литр воды, охладев на один градус, сможет согреть метр кубический воздуха на четыре градуса.
Для чего предназначена буферная емкость?
- ГВС дома.
- Снабжение постоянного температурного режима в доме.
- Увеличение КПД и продуктивности работы отопительного оборудования при минимальных денежных тратах на обогрев всего дома.
- При нужде создается общий контур, когда существует не один котёл.
- Накопление тепловой энергии, в избытке вырабатываемую котлом.
Главный минус – любой бак аккумулятор для горячей воды имеет ограничение по объему, и, соответственно, чем больше теплоаккумулятор, тем больше свободного места надо для его размещения.
Чаще всего аккумулятор воды при котельной монтируется в системах отопления и c горячим водоснабжением c котлом на твердом тепливе. Принцип работы теплоаккумулятора таков, что он обеспечивает оптимальное эксплуатирование продуктов горения, используемых в котле. В паре с электрокотлами бак-аккумулятор используется для накапливания тепла при выборе экономного режима работы.
Также аккумулятор косвенного нагрева может принимать участие в работе гелиосистем, ветрогенераторах, ГВС, для разогрева, которых используют комбинированное топливо.
Как и было описано выше, конструкция буферной емкости необычайно проста, но в зависимости от обстоятельств использования, различают следующие компоненты:
- теплообменник в нижней части аккумулирующего бака;
- встроенный бак для воды системы горячего водоснабжения;
- вмонтированный теплообменник для системы ГВС;
- Электрод из магниевого сплава;
- Электрический нагреватель;
- Прибор, который дает возможность получать постоянный поток горячей воды с неизменными показателями температуры.
Количество патрубков разнится, поскольку к единственному агрегату может быть пристыковано больше одного источника и потребителя тепла.
Как работает бак аккумулятор горячей воды?
Принцип работы теплового аккумулятора базируется на эксплуатации высокой теплоёмкости воды. Длительность производительности системы отопления на аккумулированном тепле обусловлено мощностью системы и объёмом емкости. Следовательно, покупая изделие необходимо определить, который из факторов наиболее важен: снабдить теплом систему требуемой мощности в ходе установленного периода либо гарантировать накапливание тепла от генератора определённой емкости на протяжении определённого времени.
Еще фактором, определяющий пользу тепловых аккумуляторов, является принцип работы аккумулирующего бака, когда он становится звеном, которое объединяет источников тепла. К примеру, когда цена гелиоколлекторов еще более уменьшится, а действенность повысится – можно без значительных изменений переделать отопительную систему в доме так, чтобы максимально отапливать помещения за счет общедоступной энергии светила, однако без солнечной энергии использовать твердотопливный котел.
При выборе бак-аккумулятора горячей воды принцип работы необходимо учитывать, чтобы понимать потребность в установке. Потребитель обязан принимать во внимание следующие пункты, чтобы деньги не были потрачены зря:
- Если существует ночной тариф, когда цена на топливо меньше.
- В случае если надо обеспечение дома большим объемом горячей воды.
- Если применяется разное топливо с различными коэффициентами тепловыделения. Тогда бак поможет защитить систему от перепадов температур.
Покупая готовое изделие либо изготавливая его самостоятельно, принимайте в расчет все характеристики агрегата. От них зависит прочность, безотказность и время эксплуатирования.
Установку емкости делают, исходя из чертежа, плана и руководства по сборке. Но примите к сведению:
Условия сборки агрегата
- Наличие термометров и запорной арматуры на всех трубопроводах.
- Все подключение следует делать на фланцевых соединениях.
- Компонентам агрегата не полагается чувствовать статической нагрузки от трубопроводов.
- Поблизости от теплоаккумулятора необходимо смонтировать дренажный кран.
- Не забывайте про сетчатые фильтры.
- При условии, что модель емкости не предусматривает вверху изделия штуцер для выхода воздуха — тогда разместите его на выходящем патрубке из верхней части агрегата.
- Необходимо смонтировать вблизи аккумулирующей емкости прибор для измерения давления газа и жидкостей в замкнутом пространстве и защитный клапан.
Условия установки
- Строение бака не изменяйте.
- Проследите, чтобы к ревизионному фланцу имелся подступ в любой момент.
- Плоскость для монтажа бака должна выдержать массу изделия с водой.
- Помещение необходимо отапливать.
- Поверхность аккумулирующего бака непременно должна быть теплоизолированная.
Следовательно, верно сделав все расчеты и понимая бак аккумулятор горячей воды принципы работы, можно без особых усилий добиться сильного снижения расхода топлива для обеспечения дома теплом.
Принципы работы свинцового аккумулятора |
Свинцовые аккумуляторы
Свинцовые аккумуляторы являются вторичными химическими источниками тока, которые могут использоваться многократно. Активные материалы, израсходованные в процессе разряда, восстанавливаются при последующем заряде. Химический источник тока представляет собой совокупность реагентов (окислителя и восстановителя) и электролита. Восстановитель (отрицательный электрод) электрохимической системы в процессе токообразующей реакции отдает электроны и окисляется, а окислитель (положительный электрод) восстанавливается. Электролитом, как правило, является жидкое химическое соединение, обладающее хорошей ионной и малой электронной проводимостью. В свинцовом аккумуляторе в токообразующих процессах участвуют двуокись свинца (диоксид свинца) РЬО2 (окислитель) положительного электрода, губчатый свинец РЬ (восстановитель) отрицательного электрода и электролит (водный раствор серной кислоты H2S04). Активные вещества электродов представляют собой относительно жесткую пористую электронопроводящую массу с диаметром пор 1,5 мкм у РЬО2 и 5-10 мкм у губчатого свинца. Объемная пористость активных веществ в заряженном состоянии — около 50%. Часть серной кислоты в электролите диссоциирована на положительные ионы водорода Н+ и отрицательные ионы кислотного остатка (SO4)2-. Губчатый свинец при разряде аккумулятора выделяет в электролит положительные ионы двухвалентного свинца РЬ2+. Избыточные электроны отрицательного электрода по внешнему участку замкнутой электрической цепи перемещаются к положительному электроду, где восстанавливают четырехвалентные ионы свинца РЬ4+ до двухвалентного свинца РЬ2+. Положительные ионы свинца РЬ2+ соединяются с отрицательными ионами кислотного остатка (SO2)2-, образуя на обоих электродах сернокислый свинец РЬSО4 (сульфат свинца). При подключении аккумулятора к зарядному устройству электроны движутся к отрицательному электроду, нейтрализуя двухвалентные ионы свинца РЬ2+. На электроде выделяется губчатый свинец РЬ. Отдавая под влиянием напряжения внешнего источника тока по два электрона, двухвалентные ионы свинца РЬ2+ у положительного электрода окисляются в четырехвалентные ионы РЬ4+. Через промежуточные реакции ионы РЬ4+ соединяются с двумя ионами кислорода и образуют двуокись свинца РЬO2. Химические реакции в свинцовом аккумуляторе описываются уравнением: содержание в электролите серной кислоты и плотность электролита уменьшаются при разряде и увеличиваются при заряде. По плотности электролита судят о степени разряженности свинцового аккумулятора: где ΔCp — степень разряженности аккумулятора, %;РЗ и Рр — плотность электролита соответственно полностью заряженного и полностью разряженного аккумулятора при температуре 25°С, г/см2;Р25 — измеренная плотность электролита, приведенная к температуре 25°С, г/см3. Расход кислоты у положительных электродов больше, чем у отрицательных. Если учитывать количество воды, образующейся у положительных электродов, то количество кислоты, необходимое для них в течение разряда, в 1,6 раза больше, чем для отрицательных. При разряде происходит незначительное увеличение объема электролита, а при заряде — уменьшение (около 1 см3 на 1 А·ч). На 1 А·ч электрической емкости расходуется: при разряде — свинца 3,86 г, диоксида свинца 4,44 г, серной кислоты 3,67 г, а при заряде — воды 0,672 г, сульфата свинца 11,6 г.
ЩЕЛОЧНЫЕ АККУМУЛЯТОРЫ
Щелочными аккумуляторами называют такие аккумуляторы, в которых в качестве электролита используется щелочь, например раствор едкого натрия или едкого калия. Электроды (пластины) в щелочных аккумуляторах выполнены из никелированного железа, в которые запрессовывается активная масса. Корпус щелочных аккумуляторов выполняют из никелированного стального листа. В качестве активной массы в щелочных аккумуляторах, к примеру — в кадмиево-никелевых, для положительных пластин используется гидрат закиси никеля в смеси с графитом, а в отрицательных пластинах — кадмий и окись железа. Электролит в щелочных аккумуляторах в процессе работы не расходуется и не меняет своей плотности. Это замечательное свойство позволяет корпус аккумулятора выполнить герметичным. Такая конструкция не требует никакого дополнительного обслуживания, кроме циклических зарядов после разряда. В зависимости от типа применяемой активной массы щелочные аккумуляторы называют: железо-никелевые (окись никеля и железо), кадмиево-никелевые (окись никеля и кадмий), серебряно-цинковые (положительные электроды из чистого серебра, а отрицательные пластины из спрессованной смеси окиси цинка и цинкового порошка, электролит из едкого калия).
Основные характеристики аккумуляторов
Основные характеристики у аккумуляторов такие же, как и у гальванических элементов, дополнительные — это зарядная емкость, коэффициент отдачи, срок службы и годности. Зарядная емкость аккумулятора — количество электричества, преобразованного в химическую энергию, накопленную при полном заряде аккумулятора. Коэффициент отдачи, определяется соотношением разрядной емкости к зарядной емкости. Коэффициент отдачи по энергии — отношение энергии, полученной аккумулятором, к энергии, отданной при разряде. Срок службы — наработка по времени, при которой его разрядная емкость сделается меньше определенной нормативной величины. Срок годности аккумулятора — сумма срока хранения и времени эксплуатации, в течение которого наработка аккумулятора достигает срока его службы.
Принцип работы литий-ионных аккумуляторов-Dongguan Perfect Amperex Technology Limited
Портативные электронные изделия с аккумулятором в качестве источника питания. С быстрым развитием портативных продуктов, все виды дозировки батареи и разработаны многие новые типы батареи. В дополнение ко всем хорошо знакомым высокопроизводительным щелочным батареям, никель-кадмиевым аккумуляторным батареям, никель-металлогидридным батареям, а в последние годы — развитию литиевых батарей.Здесь представлены основные сведения о литий-ионных батареях. Включая его характеристики, основные параметры, тип, область применения и важность использования вопросов, требующих внимания, и т. Д.
Плотность энергии различных типов элементов
Литий — это разновидность металлических элементов, химический символ Ли (англ. lithium) — это серебристо-белый, очень мягкий и живой металл, химически активный, самый легкий в металле. Помимо использования в атомной энергетике, он может производить специальные сплавы, специальное стекло (стекло экрана телевизора) и литиевые батареи.Он используется в качестве батареи в аноде литиевой батареи.
Литий-ионные аккумуляторы делятся на две категории: незаряжаемые и аккумуляторные. Неперезаряжаемые батареи как одноразовые батареи, это может быть только химическая энергия в электрическую энергию за один раз, электричество не может превратиться в химическую энергию (или низкая эффективность восстановления). Аккумуляторная батарея называется вторичной батареей (также известной как аккумулятор). Он может преобразовывать электрическую энергию в химическое хранилище энергии, при использовании, а затем преобразовывать химическую энергию в электрическую энергию, это обратимо, например, основные характеристики электричества химическая энергия литиевых батарей.
Катодный материал ионно-литиевой батареи обычно имеет активность соединений лития, катод представляет собой особую молекулярную структуру углерода. Общий катодный материал основных ингредиентов для LiCoO2, зарядки и положительного полюса соединения силы электрического потенциала батареи высвобождает ион лития, встроенные отрицательные молекулы расположены в структуре слоев углерода. Разрядка, ионы лития из слоистой структуры осаждения углерода, и анодные соединения снова объединяются.Литий-ионный ток мобильного.
Хотя принцип химической реакции очень прост, но в реальном промышленном производстве больше необходимо учитывать практические проблемы: материал анода требует добавок, которые во много раз превышают активность надувания, структура материала катода на молекулярном уровне спроектировать для размещения большего количества ионов лития; Заполнение между катодным электролитом, помимо стабильного, также должно иметь хорошую электропроводность, уменьшающую внутреннее сопротивление батареи.
Хотя литий-ионные аккумуляторы имеют мало эффекта памяти никель-кадмиевых аккумуляторов, принцип эффекта памяти заключается в кристаллизации, почти не вызывая такой реакции в литиевой батарее. Тем не менее, литий-ионных аккумуляторов во многих случаях падает, а поставленная заправочная емкость все равно будет, причина этого сложна и разнообразна. В основном это изменение материалов самого анода, с молекулярного уровня, катод для дырочной структуры иона лития будет постепенно разрушаться, скопление; Материалы анода с химической точки зрения проявляют активность пассивации, появляются побочные эффекты для образования стабильных других соединений.Физические также будут появляться на материале анода, постепенно растрескиваясь и т. Д., Короче говоря, в конечном итоге батарея может свободно перемещаться в процессе зарядки и разрядки литий-ионного числа.
Принцип работы и полисульфидный челнок в Li-S батареях
Вообще говоря, Li-S батареи состоят из литиевого анода, где окисление Li происходит с образованием ионов Li + , которые диффундируют через литий-проводящий электролит к катоду. На катоде происходит восстановление серы (Схема 2).
Схема 2. Принцип работы Li-S аккумулятора.
Проблема в том, что восстановление серы происходит через сложный многоступенчатый механизм и образуются различные промежуточные полисульфиды общей формулы Li 2 S n . Полярность этих соединений серы широко варьируется, причем сера неполярна, а конечный компонент Li 2 S полярен. Однако полисульфиды имеют промежуточную полярность и часто довольно хорошо растворяются в электролитах.Растворение полисульфидов истощает электроды из активных материалов. Кроме того, когда полисульфиды диффундируют в электролит, они могут легко перемещаться между катодом и анодом, и вместо полезных циклов окисления и восстановления на электродах происходит паразитное восстановление и окисление промежуточных полисульфидов, что приводит к вышеупомянутому снижению емкости. Наконец, если Li 2 S образуется на аноде, он имеет тенденцию образовывать нерастворимый слой и, следовательно, блокировать транспорт лития (Схема 3).
Схема 3. Полисульфидный шаттл в Li-S батарее.
Растворимость полисульфидов в ионных жидкостях больше всего зависит от донорных свойств анионов ИЖ. Соответственно, ИЖ с OTf — в качестве аниона достаточно хорошо растворяют полисульфиды, тогда как ИЖ, содержащие БТА — , обладают незначительной способностью растворять полисульфиды. [1] С другой стороны, противоион BF 4 — имеет тенденцию вступать в реакцию с полисульфидами и, следовательно, не дает преимущества.В этом контексте EMIM BTA, BMPyrr BTA, PMPyrr BTA и PMPip BTA были определены как наиболее успешные кандидаты для электролитов Li-S аккумуляторных батарей.
В связи с высоким потенциалом Li-S батарей, IOLITEC в настоящее время участвует в нескольких исследовательских проектах по этой теме. Если вас интересует применение ИЖ в качестве электролитов, свяжитесь с нами.
Текст и иллюстрация: д-р Светлана Каду, 2018 г.[1] Ж.-В. Пак, К. Ямаути, Э. Такашима, Н. Татикава, К.Уэно, К. Докко, М. Ватанабэ, J. Phys. Chem. С 2013 , 117 , 4431.
Принцип работы и защита зарядного устройства_Greenway battery
Зарядное устройство — это устройство, используемое для обеспечения энергией аккумуляторных элементов, пропуская через них электрический ток. Другими словами, зарядное устройство для аккумуляторов — это устройство, которое обеспечивает постоянный ток для аккумуляторов, заменяя израсходованный электролит.
По сути, зарядное устройство для аккумуляторов работает путем подачи электрического тока на аккумуляторы в течение определенного времени, когда ожидается, что элементы будут удерживать энергию, передаваемую им зарядными устройствами.Основная функция зарядного устройства для аккумулятора — восстановить емкость аккумулятора, а лучшее зарядное устройство для восстановления емкости — это автоматическое зарядное устройство; однако следует также понимать и его недостатки. Зарядное устройство обычно защищено от перегрузки по току и перегрева.
Как узнать, работает ли зарядное устройство?
Существуют различные типы зарядных устройств, используемых в различных устройствах, например, в компьютерах, сотовых телефонах и автомобилях. Зарядные устройства для аккумуляторов работают по-разному в каждом устройстве, и в большинстве случаев они могут работать, подключив аккумулятор к зарядному устройству или поместив аккумулятор внутрь зарядного устройства.
Самый простой способ узнать, правильно ли работает зарядное устройство, — это проверить его на аккумуляторах. Первым делом убедитесь, что ваше зарядное устройство подключено к электрической розетке и убедитесь, что в данный момент нет батарей. Во-вторых, включите вольтметр и, в-третьих, подключите аккумуляторные батареи к зарядному устройству и убедитесь, что используемые батареи совместимы с зарядным устройством.
Шаг четвертый, проверьте показания вольтметра и убедитесь, что стрелка вольтметра показывает с правой стороны, и это показывает, что зарядное устройство заряжает аккумулятор.Если слева отображается, значит, ваше зарядное устройство не работает. На пятом шаге продолжайте проверять зарядное устройство, чтобы определить количество энергии, которое оно отдает вашей батарее. В случае отрицательного показания ваших батарей логическим объяснением будет то, что ваше зарядное устройство плохое, и вам следует подумать о приобретении нового.
С другой стороны, если вы заметили, что ваше зарядное устройство пропускает через него достаточный ток, значит, проблема не в зарядном устройстве; скорее дело в батареях.Важно отметить, что тестирование любого зарядного устройства, независимо от устройства, на котором оно используется, процесс одинаков.
Как работает зарядное устройство?
Как упоминалось ранее, зарядное устройство для аккумуляторов работает, обеспечивая аккумуляторы электрическим током. Обычно зарядное устройство для аккумуляторов представляет собой источник питания постоянного тока, в котором входное напряжение сети переменного тока понижается до определенного уровня. Здесь используемый трансформатор всегда вырабатывает большой ток, как того требуют некоторые батареи, например свинцово-кислотные.
В зарядном устройстве также используется мостовой выпрямитель, который выпрямляет слабый переменный и постоянный ток. Кроме того, постоянный ток подается в электрическую цепь, которая регулирует напряжение до постоянного уровня. Таким образом, напряжение подается на заряжаемую батарею, а энергия поступает и накапливается посредством внутреннего процесса батареи, который происходит посредством химической реакции.
Существуют автоматические зарядные устройства, в которые встроена цепь датчика напряжения, которая регулирует и измеряет напряжение заряжаемой батареи.Например, когда напряжение аккумулятора достигает оптимального уровня, зарядное устройство автоматически отключается.
Есть разные категории зарядных устройств, и все работают по-разному; например, есть зарядные устройства, обеспечивающие очень малый ток. Существуют также быстрые зарядные устройства, которые быстро заряжают большинство аккумуляторов, в то время как медленным зарядным устройствам требуется много часов для полной зарядки.
Многие зарядные устройства работают одинаково, хотя они немного отличаются из-за различных устройств, на которых они используются.Например, зарядное устройство для автомобильного аккумулятора и зарядное устройство для телефона работают одинаково. Важно отметить, что зарядные устройства для аккумуляторов изготавливаются специально для конкретных аккумуляторов.
Люди должны помнить, что аккумулятор и зарядное устройство идут рука об руку, как лошадь и ее повозка. Поэтому при выборе зарядного устройства, которое лучше всего подходит для их аккумуляторов, они должны сначала узнать, как они работают, их химический состав, а также условия, в которых они работают. Например, есть батареи, которые не могут работать в экстремально холодных условиях
Как защитить зарядное устройство?
В основном зарядные устройства аккумуляторов защищены от перегрузки по току с помощью адаптера.Метод защиты зарядного устройства включает следующие этапы; Сначала включается переключатель адаптера, который обеспечивает получение электроэнергии от адаптера к зарядному устройству.
Во-вторых, убедитесь, что ваш импульсный регулятор управляется, что обеспечит постоянный электрический ток между портом батареи и импульсным регулятором. Более того, должно ощущаться падение напряжения, которое проходит между импульсным стабилизатором и портом аккумулятора.
Также следует сравнить измеренное падение напряжения с одним опорным напряжением, и если измеренное напряжение превышает опорное напряжение, то работа переключателя адаптера изменяется, и в этом процессе зарядное устройство батареи защищается от состояния перегрузки по току. .
Зарядные устройства для аккумуляторов, особенно те, которые не отключаются автоматически, когда аккумулятор полностью заряжен, их необходимо отключить от аккумулятора, чтобы уменьшить перегрев и перегрузку по току.
В заключение, очевидно, что зарядное устройство для аккумуляторов работает по принципу, при котором оно подает энергию на аккумуляторы, и что оно хорошо работает с совместимыми аккумуляторами. Некоторые зарядные устройства сделаны специально для некоторых зарядных устройств. Кроме того, зарядные устройства защищены от двух факторов: перегрузки по току и перегрева.Кроме того, можно определить, может ли его или ее зарядное устройство работать при тестировании, и для этого можно использовать вольтметр и другие устройства.
Поэтому очень важно тщательно заботиться о своих зарядных устройствах и обеспечивать их совместимость с соответствующими батареями. Кроме того, пользователь должен понимать различные типы зарядных устройств для аккумуляторов, чтобы легко идентифицировать те, которые следует отключать вручную, и те, которые отключаются автоматически.
литий-ионный аккумулятор аккумулятор для электровелосипеда литиевая батарея
Произошла ошибка при настройке пользовательского файла cookie
Этот сайт использует файлы cookie для повышения производительности.Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно. Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались.Чтобы принять файлы cookie с этого сайта, используйте кнопку «Назад» и примите файлы cookie.
- Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г., браузер автоматически забудет файл cookie. Чтобы исправить это, установите правильное время и дату на своем компьютере.
- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie.Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Чтобы предоставить доступ без файлов cookie потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в файлах cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
Как работает аккумулятор для начинающих
Определение батареи
Хосе Луис Пелаес / Getty Images
Батарея, которая на самом деле является электрическим элементом, представляет собой устройство, вырабатывающее электричество в результате химической реакции.Строго говоря, батарея состоит из двух или более ячеек, соединенных последовательно или параллельно, но этот термин обычно используется для одного элемента. Ячейка состоит из отрицательного электрода; электролит, проводящий ионы; сепаратор, также ионный проводник; и положительный электрод. Электролит может быть водным (состоящим из воды) или неводным (не состоящим из воды), в жидкой, пастообразной или твердой форме. Когда элемент подключен к внешней нагрузке или устройству, которое должно быть запитано, отрицательный электрод подает ток электронов, которые проходят через нагрузку и принимаются положительным электродом.Когда внешняя нагрузка снимается, реакция прекращается.
Первичная батарея — это батарея, которая может преобразовывать свои химические вещества в электричество только один раз, а затем ее нужно выбросить. У вторичной батареи есть электроды, которые можно восстановить, пропустив через нее электричество; также называемый аккумуляторной или аккумуляторной батареей, его можно многократно использовать повторно.
Батареи бывают нескольких стилей; наиболее известны одноразовые щелочные батареи.
Что такое никель-кадмиевый аккумулятор?
Первая батарея NiCd была создана Вальдемаром Юнгнером из Швеции в 1899 году.
Эта батарея использует оксид никеля в положительном электроде (катоде), соединение кадмия в отрицательном электроде (аноде) и раствор гидроксида калия в качестве электролита. Никель-кадмиевый аккумулятор является перезаряжаемым, поэтому он может циклически повторяться. Никель-кадмиевый аккумулятор преобразует химическую энергию в электрическую при разряде и преобразует электрическую энергию обратно в химическую энергию при перезарядке. В полностью разряженной батарее NiCd катод содержит гидроксид никеля [Ni (OH) 2] и гидроксид кадмия [Cd (OH) 2] на аноде.Когда аккумулятор заряжается, химический состав катода изменяется, и гидроксид никеля превращается в оксигидроксид никеля [NiOOH]. На аноде гидроксид кадмия превращается в кадмий. Когда батарея разряжается, процесс происходит в обратном порядке, как показано в следующей формуле.
Cd + 2h3O + 2NiOOH -> 2Ni (OH) 2 + Cd (OH) 2
Что такое никель-водородная батарея?
Никель-водородная батарея впервые была использована в 1977 году на борту U.С. Спутник навигационной техники ВМФ-2 (НТС-2).
Никель-водородный аккумулятор можно рассматривать как гибрид никель-кадмиевого аккумулятора и топливного элемента. Кадмиевый электрод был заменен на газообразный водородный электрод. Эта батарея визуально сильно отличается от никель-кадмиевой батареи, потому что ячейка представляет собой сосуд высокого давления, который должен содержать более одной тысячи фунтов на квадратный дюйм (psi) газообразного водорода. Он значительно легче никель-кадмиевого, но его сложнее упаковать, как ящик для яиц.
Никель-водородные батареи иногда путают с никель-металлогидридными батареями, которые обычно используются в сотовых телефонах и ноутбуках. Никель-водородные, а также никель-кадмиевые батареи используют один и тот же электролит — раствор гидроксида калия, который обычно называют щелочью.
Стимулы к разработке никель-металлогидридных (Ni-MH) аккумуляторов исходят от насущных проблем со здоровьем и окружающей средой, направленных на поиск замены никель-кадмиевых аккумуляторных батарей.Из-за требований безопасности рабочих, обработка кадмия для батарей в США уже находится в процессе свертывания. Более того, экологическое законодательство 1990-х и 21-го века, скорее всего, потребует сокращения использования кадмия в батареях для бытового использования. Несмотря на это давление, никель-кадмиевые батареи, после свинцово-кислотных аккумуляторов, по-прежнему занимают наибольшую долю на рынке аккумуляторных батарей. Дальнейшие стимулы для исследования водородных аккумуляторов проистекают из общей убежденности в том, что водород и электричество вытеснят и в конечном итоге заменят значительную часть энергоносителей, вносимых ископаемыми топливными ресурсами, став основой устойчивой энергетической системы, основанной на возобновляемых источниках.Наконец, существует значительный интерес к разработке Ni-MH аккумуляторов для электромобилей и гибридных автомобилей.
Никель / металлогидридная батарея работает в концентрированном электролите КОН (гидроксид калия). Электродные реакции в никель / металлогидридной батарее следующие:
Катод (+): NiOOH + h3O + e- Ni (OH) 2 + OH- (1)
Анод (-): (1 / x) MHx + OH- (1 / x) M + h3O + e- (2)
Всего: (1 / x) MHx + NiOOH (1 / x) M + Ni (OH) 2 (3)
Электролит KOH может переносить только ионы OH-, а для уравновешивания переноса заряда электроны должны циркулировать через внешнюю нагрузку.Электрод оксигидроксида никеля (уравнение 1) был тщательно исследован и охарактеризован, и его применение было широко продемонстрировано как для наземных, так и для аэрокосмических применений. Большинство текущих исследований в области никель / металлогидридных аккумуляторов связано с улучшением характеристик металлогидридного анода. В частности, это требует разработки гидридного электрода со следующими характеристиками: (1) длительный срок службы, (2) высокая емкость, (3) высокая скорость заряда и разряда при постоянном напряжении и (4) удерживающая способность.
Что такое литиевая батарея?
Что такое литиевая батарея ?. НАСАЭти системы отличаются от всех ранее упомянутых батарей тем, что в электролите не используется вода. Вместо этого они используют неводный электролит, который состоит из органических жидкостей и солей лития для обеспечения ионной проводимости. Эта система имеет гораздо более высокие напряжения элементов, чем системы с водным электролитом. Без воды выделение водорода и кислорода исключается, и клетки могут работать с гораздо более широкими потенциалами.Они также требуют более сложной сборки, так как она должна производиться в почти идеально сухой атмосфере.
Ряд неперезаряжаемых батарей был впервые разработан с металлическим литием в качестве анода. Коммерческие монетные элементы, используемые в современных часовых батареях, в основном состоят из лития. В этих системах используются различные катодные системы, которые достаточно безопасны для использования потребителями. Катоды изготовлены из различных материалов, таких как монофторид углерода, оксид меди или пятиокись ванадия. Все системы с твердым катодом ограничены по скорости разряда, которую они поддерживают.
Для получения более высокой скорости разряда были разработаны системы с жидким катодом. Электролит в этих конструкциях является реактивным и реагирует на пористом катоде, который обеспечивает каталитические центры и сбор электрического тока. Несколько примеров этих систем включают литий-тионилхлорид и литий-диоксид серы. Эти батареи используются в космосе и в военных целях, а также в качестве аварийных маяков на земле. Обычно они недоступны для широкой публики, потому что они менее безопасны, чем системы с твердым катодом.
Считается, что следующим шагом в технологии литий-ионных аккумуляторов станет литий-полимерный аккумулятор. Эта батарея заменяет жидкий электролит гелеобразным или твердым электролитом. Предполагается, что эти батареи будут даже легче, чем литий-ионные, но в настоящее время нет планов использовать эту технологию в космосе. Он также не всегда доступен на коммерческом рынке, хотя может быть уже совсем скоро.
Оглядываясь назад, можно сказать, что мы прошли долгий путь с момента появления дырявых батарей для фонарей в шестидесятых годах, когда зародился космический полет.Существует широкий спектр доступных решений для удовлетворения многих требований космических полетов, от 80 градусов ниже нуля до высоких температур солнечного пролета. Можно выдерживать массивное излучение, десятилетия эксплуатации и нагрузки, достигающие десятков киловатт. Будет продолжаться развитие этой технологии и постоянное стремление к усовершенствованию аккумуляторов.
Как аккумуляторы накапливают и разряжают электричество?
Кеннет Бакл, приглашенный научный сотрудник Центра исследований интегрированного производства при Рочестерском технологическом институте, дает это объяснение.Этот вопрос, который кажется простым и прямым, на самом деле наполнен тонкостью и сложностью. Во-первых, необходимо установить определение батареи. Существует множество химических и механических устройств, которые называются батареями, хотя они работают на разных физических принципах. Батарея для целей этого объяснения будет устройством, которое может накапливать энергию в химической форме и преобразовывать эту накопленную химическую энергию в электрическую, когда это необходимо. Это самые распространенные аккумуляторы, имеющие привычную цилиндрическую форму.Нет батарей, которые действительно хранят электрическую энергию; все батареи хранят энергию в какой-то другой форме. Даже в рамках этого ограничительного определения существует множество возможных химических комбинаций, которые могут накапливать электрическую энергию — список слишком длинный, чтобы вдаваться в его краткое объяснение.
Существует два основных типа химических аккумуляторных батарей: перезаряжаемые, или вторичные, и неперезаряжаемые, или первичные. С точки зрения хранения энергии или разряда электричества они похожи, это просто вопрос того, допускают ли задействованные химические процессы многократную зарядку и разрядку.
Прежде чем ответить на этот вопрос, также необходимо различать гальванический элемент и батарею, как я это определил. Первый — это основная единица электрохимического накопления и разряда. Батарея состоит, по крайней мере, из одной, но, возможно, из множества таких соединенных соответствующим образом элементов. Поскольку фактическое действие накопления и разряда происходит в ячейке, этот ответ будет сосредоточен на том, что происходит на этом уровне.
Все электрохимические ячейки состоят из двух электродов, разделенных некоторым расстоянием.Пространство между электродами заполнено электролитом — ионной жидкостью, проводящей электричество. Один электрод — анод — позволяет электронам выходить из него. Другой — катод — их принимает. Энергия накапливается в определенных соединениях, составляющих анод, катод и электролит — например, цинке, меди и SO 4 соответственно.
Если предположить, что батарея приобрела свое заряженное состояние в результате перезарядки или производства, совокупный эффект химических реакций, происходящих между анодом и катодом, приводит к разряду электричества.Анод подвергается так называемой реакции окисления: во время разряда два или более иона электролита объединяются с анодом, образуя соединение и высвобождая один или несколько электронов. Одновременно катод подвергается реакции восстановления, в которой материал, из которого сделан катод, ионы и свободные электроны объединяются с образованием соединений.
Проще говоря, химическая реакция на аноде высвобождает электроны, а реакция на катоде их поглощает. Когда электрический путь, обеспечиваемый электролитом и внешней электрической цепью, соединяет анод и катод, две одновременные реакции протекают, и электроны, освобожденные на аноде, проходят через внешнее электрическое соединение и химически реагируют на катоде, заставляя элемент функционировать.Ячейка может продолжать разряжаться до тех пор, пока на одном или обоих электродах не закончатся реагенты для соответствующих реакций. В первичной ячейке это означает конец ее срока службы, а во вторичной — это просто время для подзарядки. Для вторичных элементов процесс перезарядки является обратным процессу разряда. Внешний источник постоянного электрического тока подает электроны к аноду и отводит их от катода, заставляя химические реакции происходить в обратном направлении до тех пор, пока элемент не перезарядится.
Вышеупомянутое представляет собой упрощенное объяснение того, как электрохимическая энергия, накопленная в элементе, удаляется в виде электрической энергии в процессе разряда и восстанавливается в процессе перезарядки вторичного элемента. Одновременно происходит гораздо больше электрохимических и тепловых процессов, и для большинства практичных комбинаций элементов, упакованных в виде батарей, невозможно полностью охарактеризовать все процессы. Следовательно, это приближение первичных реакций является лишь кратким объяснением того, что на самом деле происходит, хотя оно должно служить для иллюстрации основных принципов в действии.
Принцип работы солнечных батарей
Идея создания энергонезависимого дома весьма заманчива для любого домовладельца. Он имеет множество преимуществ, главное из которых заключается в том, что на вас не повлияют колебания тарифов на коммунальные услуги. Кроме того, вы будете продвигать кампанию «зеленой энергии», которая в настоящее время рекомендуется как способ защиты окружающей среды. К счастью, это осуществимая мечта, учитывая стремительный прогресс в области хранения энергии. Все, что вам нужно, это набор солнечных панелей или поставщик солнечной энергии, а также резервный аккумулятор, чтобы удовлетворить ваши потребности.
Солнечные батареи являются неотъемлемой частью этой установки, поскольку они обеспечивают непрерывную подачу электроэнергии в случае выхода из строя сети. В этой статье кажущаяся сложной работа этих запоминающих устройств разделена на несколько простых для понимания шагов. Обсуждение будет вращаться вокруг батареи, которая уже соединена с солнечной системой, а не автономной солнечной батареи.
Питание солнечной энергией
Когда солнечные лучи попадают на панели, видимый свет преобразуется в электрическую энергию.Электрический ток течет в батарею и сохраняется как электричество постоянного тока. Стоит отметить, что существует два типа солнечных батарей: связанные по переменному току и по постоянному току. Последний имеет встроенный инвертор, который может преобразовывать электрический ток в постоянный или переменный. Таким образом, солнечное электричество постоянного тока будет течь от панелей к внешнему инвертору, который преобразует его в энергию переменного тока, которая может использоваться вашей бытовой техникой или храниться в батарее переменного тока. В этом случае встроенный инвертор будет преобразовывать электричество переменного тока обратно в постоянный ток для хранения.
Что касается системы со связью по постоянному току, аккумулятор не имеет встроенного инвертора. Таким образом, электричество постоянного тока от солнечных панелей поступает в аккумулятор через контроллер заряда. В отличие от сети переменного тока, инвертор мощности в этой системе подключается только к домашней проводке. Таким образом, электричество от солнечных панелей или аккумуляторной батареи преобразуется из постоянного тока в переменный, прежде чем подавать на бытовую технику. От чего зависит, сколько энергии хранится в аккумуляторе? Читай дальше, чтобы узнать больше.
Процесс зарядки
Поскольку энергия поступает от солнечных панелей, электроснабжение вашего дома будет иметь приоритет. Таким образом, электричество напрямую питает ваши приборы, такие как холодильники, телевизоры и лампы. Часто этой энергии от солнечных батарей может быть больше, чем вам нужно. Например, в жаркий полдень вырабатывается много энергии, но ваш дом ее не использует. В таком сценарии происходит чистое измерение, при котором дополнительная энергия возвращается в сеть. Однако вы можете использовать этот перелив для зарядки батарей.
Количество электроэнергии, хранящейся в аккумуляторе, зависит от того, как быстро он заряжается. Если, например, ваш дом не потребляет слишком много энергии, процесс зарядки будет быстрым. Кроме того, если вы подключены к огромным панелям, в ваш дом будет поступать много электроэнергии, а это значит, что батареи будут заряжаться намного быстрее. Как только ваша батарея будет полностью заряжена, контроллер заряда предотвратит ее перезарядку.
Если вы активно стремитесь к чистой и бесплатной энергии, но у вас нет достаточно денег, чтобы инвестировать в солнечные батареи, вам обязательно стоит подумать о покупке солнечного генератора.
Зачем вам солнечная батарея?
1. Чтобы защитить вас от перебоев в подаче электроэнергии
Если вы подключены к сети, всегда будет несколько моментов, когда система передачи данных выйдет из строя или будет отключена для обслуживания. Как только это произойдет, система изолирует ваш дом от сети и активирует резервный источник. В этом случае аккумулятор будет работать как резервный генератор.
2. Тарифный план по времени использования
По этим тарифам с вас будет взиматься плата в зависимости от количества потребляемой электроэнергии, а также времени, в течение которого вы ее используете.TOU заявляет, что энергия, потребляемая из сети в ночное время, более ценна, чем дополнительная энергия, производимая в течение дня. Таким образом, накапливая дополнительную энергию и используя ее в ночное время, вы снижаете общие затраты на электроэнергию в своем доме.
Правительства по всему миру признают преимущества солнечных батарей. Настолько, что они предлагают домовладельцам скидки, чтобы помочь с первоначальной стоимостью покупки солнечной батареи. Эти скидки на солнечные батареи становятся все более популярными и являются признаком огромных преимуществ, которые батареи предоставляют домовладельцам и всему миру.Скидки на солнечные батареи помогают продвигать внедрение систем солнечной энергии во многих странах.
Заключительное слово
В связи с тем, что в мире используется «зеленая энергия», солнечные панели постепенно заменяют традиционные источники электроэнергии. Солнечные батареи играют решающую роль в обеспечении надежного электроснабжения в вашем доме. Аккумуляторные батареи с парами переменного тока имеют встроенный инвертор, который преобразует электрический ток в постоянный или переменный, в зависимости от направления.
С другой стороны, аккумуляторная батарея постоянного тока не имеет этой функции.Обе батареи, однако, накапливают электрическую энергию в постоянном токе независимо от настройки. Скорость, с которой электричество хранится в батареях, зависит от размера панелей и количества, используемого вашей бытовой техникой.
.