Как повысить плотность аккумулятора! | Статьи компании ООО «KRONVUZ» г Москва
Аккумуляторная батарея автомобиля требует к себе постоянного внимания. Ведь часто случается так, что невозможно запустить стартер после длительного простоя. Особенно, когда длительная зарядка не помогает и батарея разряжается крайне быстро. А это значит, что пришло время повысить плотность аккумулятора.
Правила безопасности при работе с электролитом
Перед тем как преступать к данной операции, необходимо запомнить следующие правила безопасности:
- Необходимо добавлять кислоту в воду, а не наоборот, поскольку эти жидкости имеют разную плотность.
- АКБ нельзя переворачивать вверх дном. В этом случае произойдет осыпание пластин и соответственно, к поломке устройства.
- Ни в коем случае нельзя доливать концентрированную кислоту в электролит.
Первое, что необходимо сделать, это проверить плотность уже заряженного АКБ.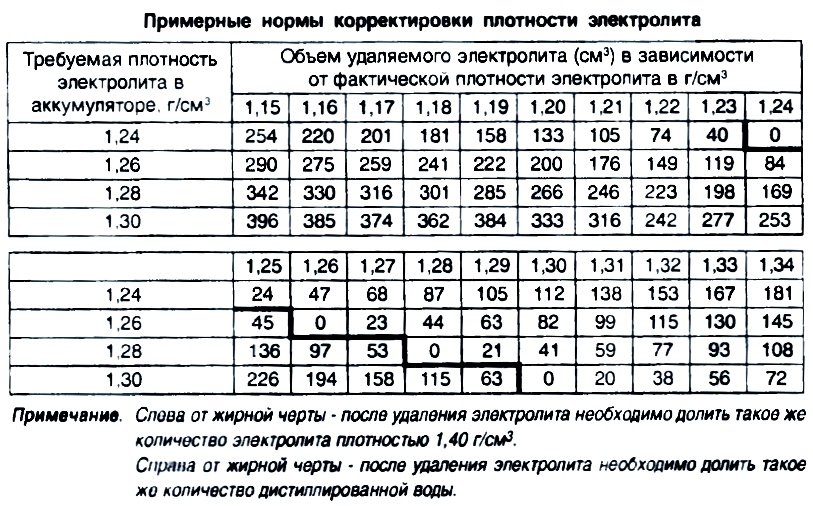
Затем при помощи резиновой груши необходимо аккуратно выкачать старый электролит из банки и залить свежий раствор плотностью 1,39 – 1,40 г/куб. см. Периодически измеряйте плотность и стремитесь к одинаковым значениям во всех банках АКБ.
Для перемешивания электролита, аккумулятор нужно поставить на заряд при малом токе в течение получаса. После этого проведите финальный замер показаний. Такие манипуляции позволят значительно продлить срок эксплуатации данного изделия. Существует несколько способов как можно повысить плотность аккумулятора, рассмотрим способ в автоматическом режиме.
Рисунок 1. Система анализа состояния и мониторинга АКБ производства компании KRONVUZ
Автоматизация процесса проверки плотности аккумулятора
А что делать, если аккумуляторных батарей большое количество и требуется постоянный контроль над их параметрами, особенно, если это вопрос безопасности? Для этого нужна автоматизация, а именно
система анализа состояния и мониторинга АКБ.
Данное устройство позволяет обеспечить контроль температуры и напряжения на каждом элементе батареи. Соответственно, не только проводить циклы выравнивания, но и выявлять поврежденные элементы. Система автоматически отключит те элементы, которые уже заряжены во избежание их преждевременного разрушения. А это значит, что срок службы аккумуляторов может быть увеличен в несколько раз.
Таким образом, можно обслуживать большое количество АКБ и значительно продлить их период эксплуатации. А это уже действительно серьезная экономия. И разумеется, обеспечение бесперебойности рабочих процессов на производстве.
Рекомендуем ознакомиться со следующими материалами:
Как повысить плотность электролита: три главных метода
Плотность – важнейшая характеристика электролита. От ее нахождения в пределах нормы напрямую зависит работоспособность аккумулятора. В прошлой статье мы узнали, в чем главная причина падения уровня плотности, а сейчас поговорим о том, как же все-таки решить эту проблему.
Корректирующая жидкость
Этот метод актуален лишь для обслуживаемых аккумуляторов. В случае необслуживаемых АКБ у водителя нет доступа к внутренней части батареи, поэтому придется искать обходные пути.
Если плотность электролита еще не дошла до критического уровня, ситуацию можно исправить с помощью добавления корректирующего электролита. Этот раствор отличается увеличенной концентрацией основного компонента – серной кислоты. Вам необходимо извлечь из банок излишек электролита с недостаточной плотностью и залить вместо него корректирующий раствор. Сделать это можно с помощью обычной груши, постоянно контролируя плотность электролита ареометром.
Зарядное устройство
Этот способ подойдет для всех видов аккумуляторов. Подключив прибор к АКБ (не забывая о полярности), подключите ваше устройство к сети. Для плавного повышения значения плотности можно выбрать силу тока в 10% от емкости аккумулятора.
Полная замена электролита
Если значение плотности опустилось до критического уровня, то первые два способа не сработают. В этом случае следует полностью заменить электролит, предварительно откачав всю старую жидкость из банок.
В этом случае следует полностью заменить электролит, предварительно откачав всю старую жидкость из банок.
Магазин «Центр-АКБ» – одно из лучших мест, где можно купить аккумулятор для авто в Нижнем Новгороде. На нашем официальном сайте вы найдете множество полезных статей и полный каталог продукции. А также сможете проконсультироваться со специалистами по вопросам выбора нового аккумулятора. Именно здесь вы найдете автомобильные аккумуляторы Варта, Bosch, Аком, Mutla и многие другие выдающиеся бренды отечественных и зарубежных производителей.
Телефон для связи: +7 (831) 416-13-13
Мы находимся по адресам:
ул. Березовская, д. 96А
ул. Деловая, д. 7к5
проспект Кирова, 12
ул. Русская улица, 5
Как поднять плотность электролита в аккумуляторе?
Многим этот вопрос кажется простым, а ответ очевидным. Слить электролит с низкой плотностью и залить с более высокой. Или слить только часть, а вместо неё добавить концентрированный раствор.
Содержание статьи
А какая плотность нормальная?
Как известно, электролит в свинцово-кислотном аккумуляторе является раствором серной кислоты (H2SO4) в воде (используется дистиллированная вода без примесей). В рамках этого материала мы не будет рассказывать о сортах серной кислоты, её плотности и т. п. Если интересно, можете прочитать это в отдельном материале про электролит.
Плотность электролита полностью заряженного аккумулятора должна быть на отметке 1,27 гр/см3. Обычно в разных банках она лежит в интервале 1,25─1,27 гр/см3.

| Плотность электролита, г/см. куб. (+15 гр. Цельсия) | Напряжение, В (в отсутствии нагрузки) | Напряжение, В (с нагрузкой 100 А) | Степень заряда АКБ, % | Температура замерзания электролита, гр. Цельсия |
|---|---|---|---|---|
| 1,11 | 11,7 | 8,4 | 0 | -7 |
| 1,12 | 11,76 | 8,54 | 6 | -8 |
| 1,13 | 11,82 | 8,68 | 12,56 | -9 |
| 1,14 | 11,88 | 8,84 | 19 | -11 |
| 1,15 | 11,94 | 9 | 25 | -13 |
| 1,16 | 12 | 9,14 | 31 | -14 |
| 1,17 | 12,06 | 9,3 | 37,5 | -16 |
| 1,18 | 12,12 | 9,46 | 44 | -18 |
| 1,19 | 12,18 | 9,6 | 50 | -24 |
| 1,2 | 12,24 | 9,74 | 56 | -27 |
| 1,21 | 12,3 | 9,9 | 62,5 | -32 |
| 1,22 | 12,36 | 10,06 | 69 | -37 |
| 1,23 | 12,42 | 10,2 | 75 | -42 |
| 12,48 | 10,34 | 81 | -46 | |
| 1,25 | 12,54 | 10,5 | 87,5 | -50 |
| 1,26 | 12,6 | 10,66 | 94 | -55 |
| 1,27 | 12,66 | 10,8 | 100 | -60 |
Плотность электролита, г/см. куб. (+15 гр. Цельсия) куб. (+15 гр. Цельсия) | Напряжение, В (в отсутствии нагрузки) | Напряжение, В (с нагрузкой 100 А) | Степень заряда АКБ, % | Температура замерзания электролита, гр. Цельсия |
Падение плотности ниже 1,15 гр/см3 (ЭДС ниже 12 В) рекомендуется не допускать.
Вернуться к содержанию
А нужно ли поднимать плотность?
Если коротко, то далеко не всех случаях требуется повышение плотности.
Аккумуляторная батарея состоит из наборов положительных и отрицательных электродов, погруженных в раствор серной кислоты. Чтобы исключить замыкание, электроды помещены в изолирующие конверт-сепараторы. Электрод состоит из решётки и обмазки.
Решётки изготавливаются по различным технологиям из разных сплавов и это тема отдельного разговора. А в качестве обмазки на отрицательных электродах присутствует порошкообразный свинец (Pb), а на положительных – паста диоксида свинца (PbO2). Последний имеет красно-коричневый цвет.
В процессе разряда АКБ на электродах протекают следующие реакции при непосредственном участии электролита.
Положительный электрод (анод)
PbO2 + SO42- + 4H+ + 2e— => PbSO4 + 2H2O
Отрицательный электрод (катод)
Pb + SO42- — 2e— => PbSO4
Общая реакция в электрохимической системе описывается уравнением
Pb + 2H2SO4 + PbO2 => 2PbSO4 + 2H2O
Как видите, в процессе разряда серная кислота из электролита взаимодействует как с диоксидом свинца на аноде и металлическим свинцом на катоде с образованием сульфата свинца (PbSO4) и воды (H2O). Ток течёт от анода к катоду. В результате реакции постепенно падает плотность электролита. Обычно нижний предел 1,1─1,15 гр/см3. К этому моменту поры обмазки забиваются сульфатом свинца и реакция сходит на нет. Напряжение на выводах к этому моменту падает до 12 вольт и ниже.
Ток течёт от анода к катоду. В результате реакции постепенно падает плотность электролита. Обычно нижний предел 1,1─1,15 гр/см3. К этому моменту поры обмазки забиваются сульфатом свинца и реакция сходит на нет. Напряжение на выводах к этому моменту падает до 12 вольт и ниже.
При заряде указанные реакции идут в обратном направлении. То есть, сульфат свинца растворяется с расходом воды и образованием Pb, PbO2 и серной кислоты. Концентрация электролита растёт и плотность увеличивается.
К чему все это было сказано? Дело в том, что плотность электролита должна повышаться «естественным путём» в результате зарядки. Если к моменту окончания заряда плотность не достигла 1,27 гр/см3, то причина проблемы не электролит, а система в целом. Конечно, это условии, что зарядное устройство (ЗУ) работает исправно и плотность вы измеряете исправным ареометром.
Итак, в чём причина пониженной плотности к моменту окончания заряда? Это процесс сульфатации, подробнее о котором можно прочитать здесь. Постепенно в процессе эксплуатации часть PbSO4 не растворяется до конца во время зарядки и накапливается на активной массе электродов. Это значит (см. реакции выше), что процессы при зарядке прошли не до конца. Поскольку растворился не весь сульфат свинца, то восстановилась не вся серная кислота и осталось больше воды. Результат – концентрация электролита меньше, как и его плотность.
Постепенно в процессе эксплуатации часть PbSO4 не растворяется до конца во время зарядки и накапливается на активной массе электродов. Это значит (см. реакции выше), что процессы при зарядке прошли не до конца. Поскольку растворился не весь сульфат свинца, то восстановилась не вся серная кислота и осталось больше воды. Результат – концентрация электролита меньше, как и его плотность.
Отсюда вывод. Чтобы поднять плотность электролита в аккумуляторе, нужно в первую очередь заниматься десульфатацией и максимально полной зарядкой АКБ. Если пониженная плотность вызвана сульфатацией, то не следует повышать её увеличением концентрации электролита. Это только усугубит ситуацию.
Даже если плотность ниже 1,27 гр/см3, все вещества остаются в электрохимической системе. Если вы искусственно увеличиваете плотность электролита, то равновесие нарушается и концентрация PbSO4 будет ещё больше. При разряде из электролита выделится сульфат свинца, который уже точно не растворится при заряде, поскольку теперь он в избытке.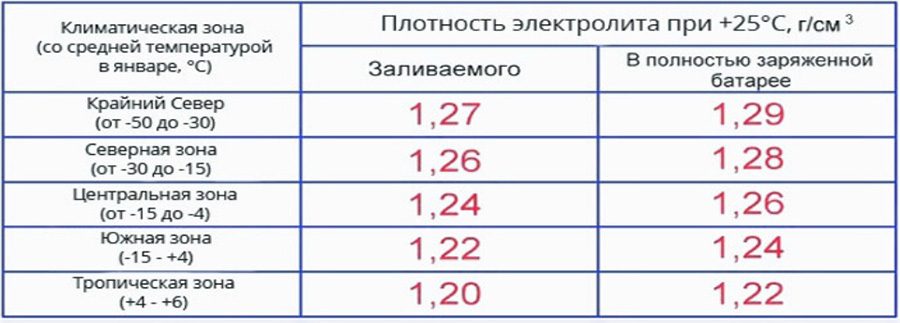 А плотность по окончании заряда снова будет ниже нормы. И так далее.
А плотность по окончании заряда снова будет ниже нормы. И так далее.
Что делать? Никому не навязываю своё мнение, но, мне кажется замена электролита (или изменение его плотности «вручную») для увеличения плотности уместна в следующих случаях.
- Перелили воды или она попала туда в результате ЧП. В результате этого снизилась плотность.
- Нужно повысить плотность электролита для использования в холодном климате.
Я менял электролит в АКБ только один раз из-за непредвиденной ситуации. Заряжал его как-то даче рядом с домом под открытым небом. Зарядил, отключил, но пробки закрывать не стал, чтобы газы вышли он отстоялся немного. Занялся другими делами и забыл про него. Пошёл ливень и все залило с верхом. Пришлось выбирать оттуда старый и заливать новый покупной электролит с нормальной плотностью. Если же просто упала плотность в результате эксплуатации, это не повод увеличивать его концентрацию.
Вернуться к содержанию
Как повысить плотность электролита в Pb аккумуляторе?
Итак, вы всё же решили поднять плотность раствора в аккумуляторной батарее. Как это сделать? Вам потребуется электролит (продаётся в автомобильных магазинах с плотностью 1,27─1,29 гр/см3), ёмкость для откачиваемого электролита, резиновая «груша», длинная гибкая трубка из материала стойкого к серной кислоте, пластиковая воронка (удобно заливать электролит обратно в банки), зарядное устройство.
Как это сделать? Вам потребуется электролит (продаётся в автомобильных магазинах с плотностью 1,27─1,29 гр/см3), ёмкость для откачиваемого электролита, резиновая «груша», длинная гибкая трубка из материала стойкого к серной кислоте, пластиковая воронка (удобно заливать электролит обратно в банки), зарядное устройство.
Внимание! Электролит является едким веществом! При попадании на кожу и слизистые вызывает сильный химический ожог! Поэтому при работе обязательно используйте очки для защиты глаз, а также резиновые перчатки для защиты рук. Если будете разводить концентрированную кислоту, помните, что нужно наливать кислоту в воду, а не наоборот. При падании электролита на кожу или слизистые нужно обратиться в больницу.
Процесс выглядит примерно так.
- Зарядили аккумулятор по максимуму.
- Выбрали старый электролит. Именно так, выбрали, откачали и т. п. С помощью гибкой трубки из материала, стойкого к кислоте и обычной резиновой «груши».
 Не допускается переворачивать АКБ для слива. В этом случае осыпавшиеся частицы со дна могут замкнуть пластины. Или электроды деформируются, порвут сепаратор и будет замыкание. В случае замыкания банки аккумулятор можно смело идти сдавать в приёмку.
Не допускается переворачивать АКБ для слива. В этом случае осыпавшиеся частицы со дна могут замкнуть пластины. Или электроды деформируются, порвут сепаратор и будет замыкание. В случае замыкания банки аккумулятор можно смело идти сдавать в приёмку. - Затем заливаете покупной или самостоятельно приготовленный электролит с плотностью 1,27─1,29 гр/см3.
- Даёте отстояться немного. При необходимости заряжаете.
Это если нужна полная замена электролита, когда он испорчен. Если же нужно увеличить концентрацию, то можно частично отобрать электролит из банок. Я для этого использую колбу от старого ареометра. Поплавок давно разбился, а колбу я оставил и использую вместо «груши».
Затем в банки заливаете такое же по объёму количество раствора более высокой концентрации. Можно использовать аккумуляторную кислоту (92─94%) плотностью 1,835 гр/см3. После этого можно поставить АКБ на зарядку для выравнивания концентрации.
 Не нужно трясти и бултыхать батарею для перемешивания. Иначе могут быть те же последствия, что и при переворачивании.
Не нужно трясти и бултыхать батарею для перемешивания. Иначе могут быть те же последствия, что и при переворачивании.Вернуться к содержанию
Опрос
Примите участие в опросе!
Загрузка …Если статья оказалась для вас полезной, распространите ссылку на неё в социальных сетях. Это поможет развитию сайта. Исправления и дополнения к материалу, а также ваше мнение о повышении плотности электролита в свинцово-кислотном аккумуляторе, оставляйте в комментариях ниже. Голосуйте в опросе и оценивайте статью.
Вернуться к содержанию
Плотность электролита в аккумуляторе: какая должна быть, как проверить, как поднять
Бортовая сеть автотранспортного средства объединяет в себе источники и потребители электроэнергии. АКБ и генератор выступают энергоисточниками, тогда как вторая группа включает в себя целый комплекс устройств и агрегатов. Среди них первостепенное значение имеют система зажигания и запуска, контрольно-измерительные приборы, сигнализация, лампы в фарах и габаритных огнях.
В электросети автомобиля также присутствует множество дополнительных приспособлений, обеспечивающих комфорт и безопасность водителя и пассажиров. К ним относятся подогрев стёкол и сидений, акустическая система, прикуриватель, GPS-навигатор, видеорегистратор и т.д.
В случае аварийного выхода из строя генератора или реле контроля напряжения именно аккумулятор берёт на себя поддержание работоспособности всех электропотребителей, сохраняя возможность безопасного передвижения автотранспорта до ближайшей станции техобслуживания. Также он стабилизирует напряжение в системе, когда двигатель длительное время работает на низких оборотах или холостом ходу, как это часто бывает при передвижении в городской черте.
На современном рынке автотоваров наибольшим потребительским спросом пользуется свинцово-кислотный АКБ, который нашёл самое широкое применение в транспортных средствах из-за своей надёжности, функциональности и высокой удельной мощности. Главными конструктивными элементами такого устройства являются шесть секций или попросту «банок», внутри которых находится блок свинцовых пластин.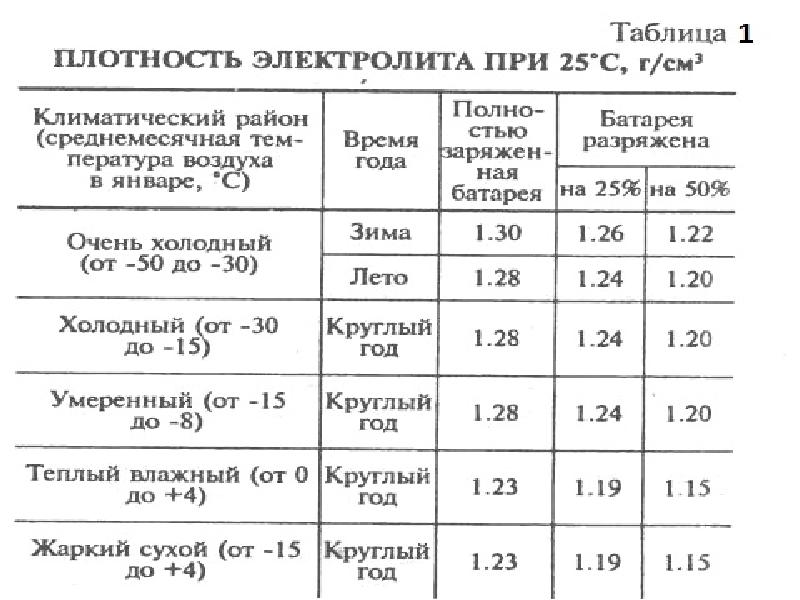
Активной массой положительного электрода является диоксид свинца, а отрицательного – чистый свинец. Между ними расположены сепараторы, основное назначение которых заключается в разделении полублоков разной полярности и препятствии возникновению самозамыканий. Все электрохимические реакции протекают в водном растворе серной кислоты – электролите. Когда батарея разряжается, его плотность снижается из-за активного расхода кислотного агента и выделения молекул воды. При заряде происходит обратный процесс.
Когда следует проверять плотность электролита в АКБ?
Эксплуатация стартерной батареи должна сопровождаться систематическим мониторингом её состояния даже при безотказном и уверенном функционировании. Это связано с тем, что снижение резервного уровня электролита из-за утечки раствора или испарения воды приводит к увеличению кислотной концентрации. Данный фактор негативно сказывается на работоспособности и продолжительности эксплуатации АКБ.
Опытные автомеханики рекомендуют проверять техническое состояние аккумулятора каждые 15-20 тыс.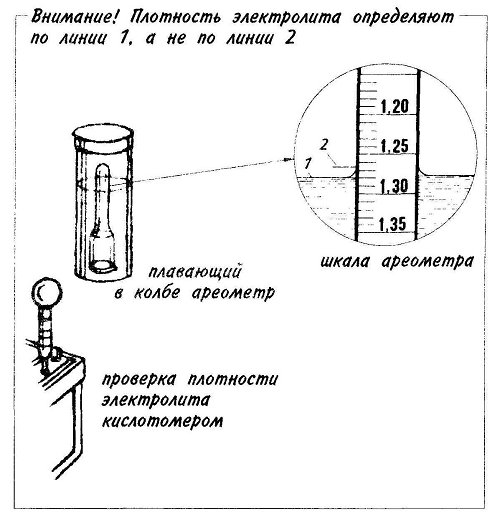 км пробега. Также диагностику целесообразно провести, если он постоянно недозаряжается, плохо держит заряд или туго крутит стартер. Для этого необходимо:
км пробега. Также диагностику целесообразно провести, если он постоянно недозаряжается, плохо держит заряд или туго крутит стартер. Для этого необходимо:
- визуально осмотреть корпус на наличие трещин и подтёков;
- оценить уровень электролитической жидкости в банках, который должен возвышаться над верхним краем пластин на 1.2-1.4 см;
- измерить её плотность с помощью контрольно-измерительного прибора.
Нередко сниженный заряд может быть следствием ослабления ремня привода генератора. Поэтому автомобилисту нужно периодически проверять его натяжение и при необходимости производить регулировку, следуя инструкции по эксплуатации ТС.
Оптимальные показатели электролитической среды
Физико-химическое состояние электролита находится в прямой зависимости от двух параметров – это температура окружающей среды и степень заряженности АКБ. При повышении температурного порога возрастает удельный вес кислоты, а при понижении — падает. Поэтому перед проведением контрольно-измерительных мероприятий аккумулятор рекомендуется выдержать в течение нескольких часов при температуре +20-25 ℃.
Типовые климатические условия региона также оказывают непосредственное влияние на плотность электролитического раствора. Так, в районах с умеренным климатом ρ= 1.27-1.28 г/см3 соответствует 100% заряда, величина 1.21 г/см3 говорит о его снижении до 60%, а 1.18 г/см3 сигнализирует о необходимости подзарядки. Измерения производятся при нормальном уровне реагента над пластинами.
В северных регионах оптимальной считается плотность электролита, равная 1.29-1.30 г/см3, а в субтропическом поясе – 1.23-1.25 г/см3. Измерение данного параметра с целью определения необходимости корректировки производится только у полностью заряженного устройства, иначе полученные результаты будут некорректными.
Алгоритм проверки плотностного состояния электролита
Определение плотности электролита осуществляется при помощи такого приспособления, как ареометр. Перед началом измерительных процедур автовладельцу следует проверить уровень спецжидкости в каждой секции АКБ и при необходимости произвести его корректировку деминерализованной водой. После этого аккумулятор необходимо полностью зарядить и по прошествии 2-3 часов приступать к тесту. Алгоритм его проведения состоит из следующих шагов:
После этого аккумулятор необходимо полностью зарядить и по прошествии 2-3 часов приступать к тесту. Алгоритм его проведения состоит из следующих шагов:
- установить устройство на ровную поверхность;
- вывернуть пробку заливного отверстия на его крышке;
- погрузить в раствор ареометр и втянуть жидкость резиновым наконечником на его противоположном конце;
- набрать количество реагента, достаточное для свободного перемещения поплавка;
- определить уровень плотности в соответствии с информацией на шкале;
- записать результат и повторить манипуляции с оставшимися банками;
- сопоставить полученные данные с нормированными значениями.
Значение плотности должно быть одинаковым во всех элементах, допускается отклонение на ±0.01. Если проведённый замер показал понижение плотности в одной из ячеек на 0.10-0.15, то это говорит о наличии дефекта или короткого замыкания между пластинами. Одинаково низкая плотность во всех блоках связана с глубоким разрядом аккумулятора, его сульфатацией или сильным износом, что влечёт за собой падение напряжения в сети и затруднённый пуск ДВС.
У необслуживаемых стартерных батарей есть особый встроенный индикатор. Если он показывает зелёный цвет, то это говорит о 100%-ном заряде АКБ, а чёрный – о необходимости его подзарядки. Бело-жёлтый или красный оттенок обычно соответствуют очень низкому уровню электролита.
Плотность электролита и зимние холода
Данная величина носит относительный характер, поэтому при смене времён года она не должна подвергаться каким-либо изменениям. Автомобилисту нужно лишь следить за тем, чтобы она не отклонялась от рекомендуемого значения, а также производить стабилизацию при обнаружении отклонений.
Производители стартерного оборудования считают недопустимым использование в зимний период устройств с 25%-ной потерей заряда, т.е. плотность электролитической среды которых составляет 1.24 г/см3. Данный факт обусловлен предотвращением возможности обледенения ячеек аккумулятора и снижением вредоносного воздействия глубокого разряда, вызванного саморазрушением активной массы пластин.
Продолжительная эксплуатация аккумулятора с пониженной плотностью в морозы приводит к снижению электродвижущей силы, затруднённому пуску двигателя, образованию льда и разрушению свинцовых пластин. Доливать деминерализованную воду с целью восстановления уровня реагента над блоками следует прямо перед выездом на улицу, либо при стационарной подзарядке батареи. Это исключает вероятность замерзания долитой воды до того, как она успеет перемешаться с холодным электролитом.
Как поднять плотность электролита?
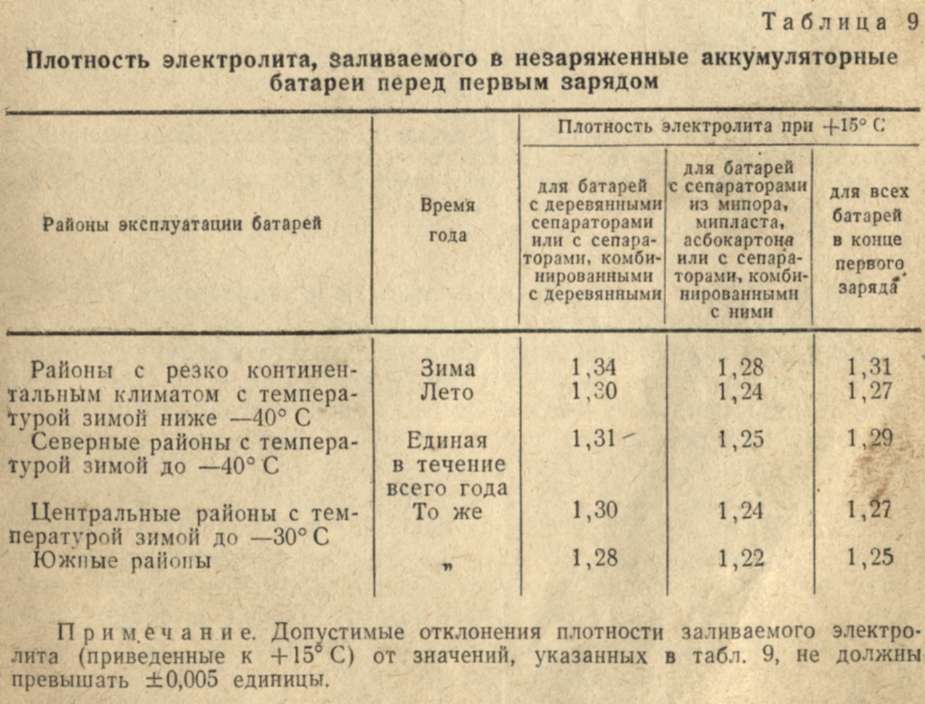
Каждый водитель может своими силами повысить плотность электролита в АКБ автомобиля, не обращаясь к мастерам сервисного центра. Первым делом нужно подготовить необходимые расходные материалы, среди которых деминерализованная вода, аккумуляторная кислота или уже готовый электролитический раствор, а также средства индивидуальной защиты для глаз и кожного покрова. Кроме того, следует обзавестись следующим оборудованием для работы: ареометром, спринцовкой, стеклянной ёмкостью, мерным стаканом и воронкой.
Снятый с автомобиля аккумулятор помещается на устойчивую поверхность, а пробки его заливных отверстий аккуратно откручиваются. Далее максимальный объём реагента выкачивается из банок и сливается в заранее подготовленный резервуар. Набирать нужно как можно больше вещества, измеряя его объём мерным стаканом, чтобы затем долить идентичное количество нового.
Лучше использовать самостоятельно разведённый раствор с плотностью немного выше расчётной для текущего климатического режима. При его приготовлении кислота добавляется в воду, обратный порядок смешения может вызвать серьёзные термические повреждения.
Сперва свежий электролит заполняет только ½ объёма, что был откачан. Затем АКБ нужно слегка встряхнуть из стороны в сторону, чтобы оставшаяся жидкость и новая перемешались. Если после замера плотностное значение не отвечает норме, добавляем ещё половину от оставшегося в ячейке объёма. Действия повторяются до полной стабилизации плотности, остаток доливается деминерализованной водой по уровню.
Как можно заметить из приведённой выше информации, работать с электролитом не представляет особой сложности, если выполнять все манипуляции по инструкции и соблюдать установленные меры предосторожности.
Повысить плотность электролита в аккумуляторе
Автор: Максим Марков
Доброго времени суток! Все читатели блога знают, что обслуживаемый аккумулятор, требует периодических проверок. Ведь концентрация серной кислоты в нем со временем падает. Поэтому, каждый уважающий себя автомобилист, должен знать, как поднять плотность электролита в аккумуляторе. Об этом, мы с вами и поговорим.
Почему плотность электролита падает
Прежде чем разбираться, как повысить плотность электролита в аккумуляторе, давайте выясним причины ее падения.
Для любого АКБ, изменение плотности это нормальное явление. Т.е., аккумулятор разрядился – ее значение понизилось. Зарядился – повысилось. Но в некоторых ситуациях, батарея попросту не держит заряд. А это говорит о том, что концентрация упала слишком сильно и ее пора поднимать.
А это говорит о том, что концентрация упала слишком сильно и ее пора поднимать.
Почему у АКБ становится маленькая плотность:
- аккумулятор просто разряжен;
- батарея подвергалась перезарядке, в результате чего выкипал электролит;
- в банки доливается дистиллированная вода, а замеры концентрации не проводятся. В результате плотность электролита постепенно падает;
Кстати, если АКБ будет долго работать в таком состоянии, это приведет к сульфитации пластин. Поэтому, лучше его не запускать.
Подготовка
Итак, если в результате проверки ареометром, обнаружилась низкая плотность электролита в аккумуляторе ее нужно поднимать. Но, прежде чем это делать, нужно убедиться, что соблюдены некоторые условия:
- АКБ заряжен;
- температура электролита в банках находится в пределах 20-25 оС;
- во всех банках уровень жидкости в норме;
- аккумулятор целый. На АКБ, часто появляются трещины возле токовыводов, из-за расшатывания контактов.
 Поэтому не нужно стучать и прикладывать излишних усилий чтобы снять клемму на аккумуляторе. Лучше потратить немного больше времени и сделать это аккуратно.
Поэтому не нужно стучать и прикладывать излишних усилий чтобы снять клемму на аккумуляторе. Лучше потратить немного больше времени и сделать это аккуратно.
Если же батарея автомобиля разряжена, то она заряжается, а после измеряется плотность. Почему так? Дело в том, что при низком заряде – концентрация кислоты в банках уменьшается.
Если залить корректирующий раствор в незаряженный аккумулятор – концентрацию серной кислоты можно повысить до такой степени, что в банках осыпятся пластины.
Нужно учесть, и тот факт, что автомобильный генератор, заряжает аккумулятор лишь на 85-90%. Поэтому перед замерами, зарядку батареи нужно проводить в обязательном порядке.
Корректирующая подзарядка АКБ
Иногда, может возникнуть ситуация, что после полной зарядки, плотность электролита в банках оказывается разная. Вообще, разница в плотности допускается не более 0,01 кг/см3. Иначе, требуется ее выравнивание.
Для этого, можно провести корректирующую подзарядку батареи. В 2-3 раза уменьшается сила тока (по сравнению с номинальной величиной) и АКБ заряжается 1-2 часа. Если это не помогло выровнять плотность электролита – потребуются более радикальные меры.
В 2-3 раза уменьшается сила тока (по сравнению с номинальной величиной) и АКБ заряжается 1-2 часа. Если это не помогло выровнять плотность электролита – потребуются более радикальные меры.
Корректирующий электролит
Корректирующим, называют электролит с плотностью 1,40 кг/см3. Запомните, ни в коем случае, нельзя просто так вливать его в АКБ. Т.е. вначале, нужно проверить аккумулятор и выяснить причину падения уровня жидкости, а потом его уже поднимать.
Часто встречается ситуация, когда начинающие автолюбители неправильно истолковывают название «корректирующий». Например, когда из банок выпарилась вода. Т.е. нужно поднять уровень жидкости, а тут как раз корректирующий раствор. Логика проста:
- в АКБ залит электролит, а его уровень упал;
- раствор корректирующий, значит он предназначен для корректировки уровня жидкости.
К сожалению, такая точка зрения в корне неправильна. В большинстве случаев, для выравнивания уровня, в АКБ льется дистиллированная вода.
А корректирующий электролит льется в таких случаях:
- если жидкость вытекла из банок;
- если вы налили в АКБ слишком много дистиллята и понизили плотность.
Поэтому не нужно его лить, если, например, батарея просто разряжена, а соответственно концентрация ниже требуемой.
Поднимаем плотность электролита в АКБ
Итак, давайте разбираться, как повысить плотность аккумулятора. Скажу сразу – дело это хоть и не хитрое, но достаточно кропотливое и к тому же, занимает много времени. Поэтому лучше заранее запастись терпением.
Нормальная плотность электролита должна быть в пределах 1,25-1,27 г/см3. Причем, это значение должно быть одинаково для всех банок. Для того чтобы поднять концентрацию электролита в банках аккумулятора, используется корректирующий раствор. Если же вы захотите самостоятельно приготовить смесь в домашних условиях, запомните последовательность:
- в емкость льется дистиллят , а уже в него добавляется серная кислота.
 Если сделать наоборот – раствор начнет бурно кипеть.
Если сделать наоборот – раствор начнет бурно кипеть.
Кроме того, понадобится:
- аэрометр с грушей для откачки жидкости из банок;
- стеклянная емкость для слива старого электролита;
- мерный стакан ;
- защитные очки , перчатки.
Важно помнить и то, что у жидкости может быть разная плотность в банках. Поэтому имеет смысл сделать простую табличку, куда заносить результаты замеров по каждой банке – иначе можно запутаться.
Сразу сделаю одно важное уточнение. Некоторые товарищи, советуя как поднять плотность в аккумуляторе, предлагают полностью выливать электролит и заливать новый. А для этого, они рекомендуют просто перевернуть батарею, вылить жидкость и промыть все дистиллированной водой. А в результате таких манипуляций перестает работать одна или несколько банок.
Почему так происходит? Дело в том, что на дне собирается свинцовый осадок. И если АКБ перевернуть – кусочки свинца могут упасть между пластин и закоротить их.
Т.е. банка перестает работать.
Итак, когда упала плотность электролита, есть несколько действенных метода, чтобы ее безболезненно поднять. Давайте их рассмотрим.
Доливка корректирующего электролита
Для этого понадобится концентрированный электролит.
Как увеличить плотность:
- из банки откачивается жидкость при помощи аэрометра или обычной спринцовки;
- вместо нее, заливается такой же объем корректирующего раствора;
- АКБ ставится на зарядку на полчаса – час, после чего, выдерживается в течение 2-3 часов;
- проводятся контрольные замеры;
- при необходимости, процедура повторяется.
При откачке, нужно следить, чтобы не оголялась поверхность пластин.
Выравнивание при помощи зарядного устройства
Здесь все просто. Единственное условие, понадобится зарядное для автомобиля с жесткой регулировкой выходного напряжения. Автоматические зарядные, уменьшающие силу тока при достижении полной зарядки не подойдут.
Как восстановить плотность:
- АКБ доводится до полной зарядки;
- когда он заряжен и начинает кипеть – уменьшается сила тока до 1-2 Ампер;
- логика простая – АКБ кипит, вода испаряется, концентрация электролита повышается;
- время выпаривания зависит от конкретного случая и может длиться больше суток;
- когда уровень упал – доливается электролит и замеряется плотность;
- если нужно – операция повторяется.
Из минусов, стоит отметить, что это долго.
Если плотность слишком низкая
Как выровнять плотность, если она слишком низкая? Например, если ее значение, ниже 1,18, описанные методы не сработают. Придется сливать кислоту полностью.
Давайте разберемся, что делать в этом случае:
- электролит откачивается из банок, насколько это возможно;
- АКБ аккуратно переворачивается, и в дне высверливаются отверстия в каждой банке.
- Желательно делать это в какой-нибудь емкости, например в тазу;
- после этого, батарея ставится в вертикальное положение, и с нее выливаются остатки жидкости;
- аккумулятор промывается дистиллированной водой;
- отверстия запаиваются, и заливается новый раствор.

Пластик для запаивания дырок, должен быть устойчивым к серной кислоте.
Иногда встречаются ситуации, когда в старых аккумуляторах совсем нет плотности. Это говорит о глубокой сульфатации. В этом случае потребуются более серьезные меры для восстановления.
На самом деле, если в вашем аккумуляторе упала плотность электролита – это не такая уж большая проблема. И поднять ее можно без особых трудов. Но, лишь в том случае, если определить падение концентрации вовремя. Если же за аккумулятором не следить – он просто выйдет из строя.
Автор: Alex 28 февраля 2017 Категория: Обслуживание и ремонт
Практически любой водитель сталкивается с такой проблемой, как быстрый разряд батареи при запуске двигателя или постоянная нехватка рабочего тока для работы стартера. Есть несколько причин, почему это происходит. Однако большинство из них связано с плотностью электролита.
В этой статье мы расскажем, как поднять плотность в аккумуляторе зарядным устройством, а также дадим пару других рекомендаций по эксплуатации аккумуляторных батареи.
Принцип работы автомобильного аккумулятораОсновной функцией аккумулятора автомобиля, по сути, является накапливание и хранение электрической энергии, которая протекает с помощью химической реакции, путем взаимодействия электролита и свинцовых пластин. Именно благодаря этим процессам вы и получаете полноценный автономный источник питания. От состояния вашего АКБ зависит не только успешность запуска двигателя, но и работа других автономных систем автомобиля.
Каждая батарея имеет свой определенный ток для холодного пуска двигателя. Он бывает разным, поэтому аккумулятор подбирается для каждого двигателя индивидуально, например, для дизеля с объемом 2500 минимальный пусковой ток должен быть не меньше 600-650 ампер, но лучше все же использовать 750 А. А количество времени, на протяжении которого батарея под нагрузкой может крутить стартер – называется емкостью аккумулятора. Измеряется этот показатель в А/ч.
Измеряется этот показатель в А/ч.
Но все же принцип работы и неисправности у всех батарей одинаковые. Принцип действия прост: в пластиковом корпусе запаяны свинцовые пластины, а пространство между ними заполнено раствором серной кислоты строго определенной плотности. Концентрация кислоты напрямую связана с плотностью, чем ее больше, тем плотность выше. Второй составной частью является дистиллированная вода (полностью очищенная от посторонних примесей).
Какая плотность электролита должна быть в аккумуляторе?Итак, при появлении первых признаков неисправностей, первое, на что мы обращаем внимание – это плотность электролита. Рабочая плотность в стартерных батареях должна быть около 1,24 – 1,30 г/см³. Замерять ее нужно специальным прибором – ареометром. При разрядке аккумулятора плотность электролита снижается, а при зарядке – увеличивается, поэтому замерять плотность следует только на полностью заряженной батарее.
Помните, что при сильном повышении температуры плотность электролита может падать, поэтому замер лучше всего проводить после 10 часов стоянки.
Из-за разного рода неисправностей в автомобиле плотность аккумулятора может уменьшиться. Также причиной снижения плотности может быть глубокий разряд АКБ и его долгий срок хранения без подзарядки. Если не устранить неполадки электросистемы автомобиля и долгое время не заряжать аккумулятор, то постоянная нехватка заряда приведет к появлению такого процесса, который называют сульфатацией. Именно он и вызывает преждевременное старение батареи. Чтобы этого избежать следует придерживаться некоторых рекомендаций по эксплуатации АКБ, которые описаны ниже в нашей статье.
Как поднять плотность в аккумуляторе зарядным устройством?Если нет дефектов пластин или при малом выпадении кристаллов свинца можно попробовать простой, но действенный метод, подняв плотность в аккумуляторе зарядным устройством. Для этого следует полностью зарядить батарею малым током. После этого оставить на 10-12 часов отстояться и снова зарядить до полной зарядки аккумулятора.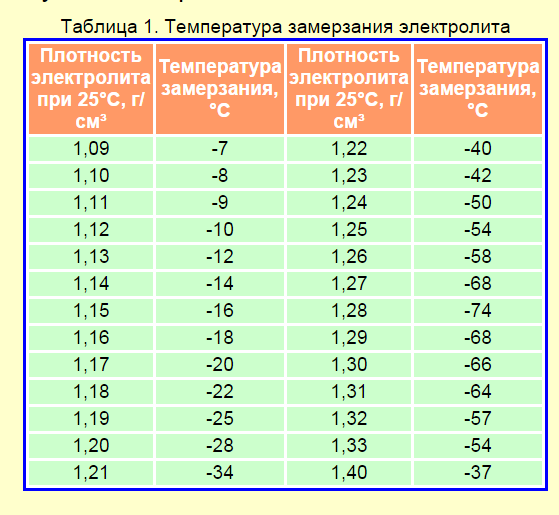 При этом напряжение следует выбрать около 14,6 – 14,8 В, а ток не более 1 – 2 Ампер. Однако этот метод подходит только в том случае, если нет явных признаков неполадки аккумулятора.
При этом напряжение следует выбрать около 14,6 – 14,8 В, а ток не более 1 – 2 Ампер. Однако этот метод подходит только в том случае, если нет явных признаков неполадки аккумулятора.
Еще одним важным условием является соблюдение определенного уровня жидкости. Дело в том, что в процессе эксплуатации в каждой секции АКБ должно быть определенное количество раствора. При повышенных температурах, которые возникают из-за нагрузок в процессе работы аккумулятора, вода может испаряться. Вследствие чего концентрация кислоты в электролите увеличивается. А это в свою очередь также ведет к сульфатации пластин, тем самым снижая емкость аккумулятора, сокращает его срок службы.
Постоянная нехватка нужного уровня электролита приводит к преждевременному старению и потере емкости аккумулятора, поэтому уровень жидкости нужно контролировать. Для глубокого смешивания раствора после доливки жидкости необходимо через некоторое время снова зарядить аккумулятор.
Для зарядки можно применять реле времени, которое автоматически отключает зарядное устройство через заданное время. Подключив реле, следует настроить его на автоматическое отключение через 15 минут. Вслед за тем делаем перерыв 15 минут и снова включаем зарядное устройство. И так до полного набора емкости АКБ.
Подключив реле, следует настроить его на автоматическое отключение через 15 минут. Вслед за тем делаем перерыв 15 минут и снова включаем зарядное устройство. И так до полного набора емкости АКБ.
Смотрим полезное видео, как восстановить свинцовый аккумулятор зарядным устройством:
Сейчас появились интеллектуальные зарядки, которые в зависимости от уровня разряда сами выбирают напряжение и ток. Такие зарядки способствуют реактивации и восстановлению аккумулятора.
Помните, что проверять плотность электролита следует только на полностью заряженной батарее. А долив дистиллированной воды следует производить лишь через некоторое время после поездки. Дело в том, что повышенная температура электролита может также влиять на объем жидкости в аккумуляторе. Такую реакцию еще называют температурным расширением. Что позволит вам не ошибиться с уровнем электролита. Так как при переизбытке жидкости в батареи электролит может вытекать через отверстия в пробках, что приводит к повышенной утечке тока аккумулятора.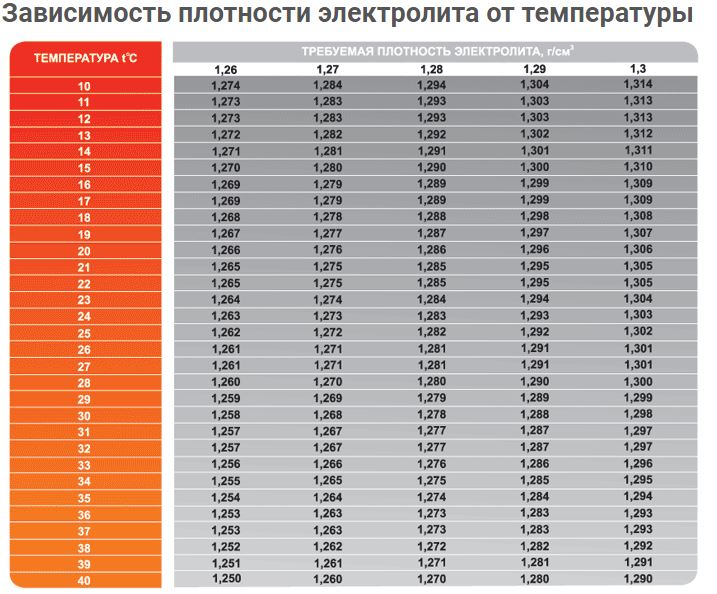
Чтобы не потерять дорогостоящую АКБ раньше срока нужно придерживаться следующих рекомендаций:
- Систематически проверять напряжение на генераторе;
- Время от времени следует полностью заряжать АКБ, так как редкая короткая подзарядка не дает возможности глубокому перемешиванию электролита и приводит к появлению кристаллов свинца на пластинах;
- Не допускается длительное хранение незаряженной батареи;
- Доливайте только воду, чтобы не превысить плотность электролита;
- Чаще следите за уровнем жидкости.
Помните, что соблюдение простых правил по уходу поможет сохранить вам дорогостоящий источник питания. А периодическая полная зарядка аккумулятора зарядным устройством поможет сохранить его в полной работоспособности.
Это все что мы хотели сказать по данному вопросу, теперь вы знаете, как поднять плотность в аккумуляторе зарядным устройством. Надеемся, что данный материал оказался для вас полезным. Чаще следите за состоянием вашего аккумулятора, и он прослужит вам долгую службу!
Надеемся, что данный материал оказался для вас полезным. Чаще следите за состоянием вашего аккумулятора, и он прослужит вам долгую службу!
Наверняка большинство автомобилистов сталкивались с ситуацией, когда оставленная на некоторое время машина перестает заводиться. При этом стартер может вообще не подавать каких-либо признаков жизни. Основной причиной этому, скорее всего, является аккумуляторная батарея, что за несколько дней полностью разрядился. Попытка зарядить ее в этом случае не приведет к положительному результату. Подобная проблема является результатом снижения плотности электролита, что залит в банки батареи …
СОДЕРЖАНИЕ СТАТЬИ
Ведь эта жидкость, по сути является катализатором электрохимического процесса, без нее аккумулятор это набор свинца и пластика, который работать не будет. Как мы с вами знаем, состоит от из дистиллированной воды (примерно 65%) и серной кислоты (35%), у этой жидкости есть определенная плотность, которая может понижаться и повышаться, в зависимости от заряженности.
Почему снижается плотность электролита?
Чаще всего с целью поддерживать на требуемом уровне количество жидкости внутри автомобильной батареи владельцы машины доливают туда дистиллированную воду. При этом редко проверяется плотность получившегося раствора. Вместе с тем, когда количество дистиллированной воды будет достаточно большим, при подзарядке вместе с этой жидкостью будет выкипать и электролит, что и приводит к снижению его плотности.
Рано или поздно этот показатель упадет ниже критического уровня, и завести транспортное средство уже не получиться.
В таком случае возникает необходимость повысить этот параметр раствора в аккумуляторе, что вернет его работоспособность.
Подготовка к восстановлению батареи
Перед тем, как своими силами повышать уровень плотности аккумуляторной батареи, к этому процессу следует тщательно подготовиться. В первую очередь:
- Замеряется этот основной показатель автомобильной батареи при температуре около 22 градусов.
 Сделать этом можно при помощи специального прибора – ареометра. При этом работать можно только в перчатках и защитных очках, чтобы избежать возможных ожогов.
Сделать этом можно при помощи специального прибора – ареометра. При этом работать можно только в перчатках и защитных очках, чтобы избежать возможных ожогов.
- При приготовлении нового электролита кислота добавляется в воду. Если же сделать наоборот, жидкость начнет кипеть, что может привести к кислотным ожогам.
- Переворачивать аккумулятор при работе с ним категорически запрещено, поскольку при этом могут посыпаться его пластины, что приведет к выходу прибора из строя.
- Наперед следует подготовить емкости, в которые будет сливаться старая жидкость и готовиться новая.
- Потребуются точные расчеты необходимого объема кислоты, поскольку в процессе зарядки плотность жидкости в АКБ возрастет.
Повышение плотности электролита
В АКБ есть несколько банок, электролитический раствор есть в каждой из них. Проверять и при необходимости повышать уровень плотности необходимо в каждой банке.
Нормальный уровень данного показателя зависит от нескольких факторов, в первую очередь – от температуры воздуха.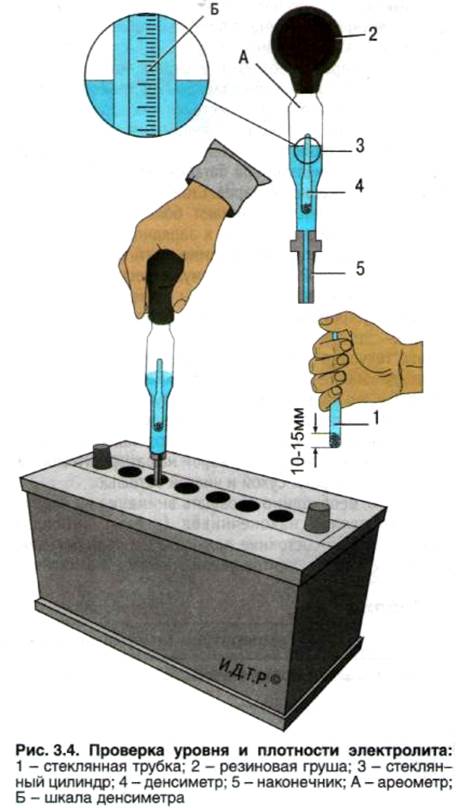 Нормальным считается значение 1,25-1,29г/см3. Разница таких показателей между банками не должна превышать 0,1.
Нормальным считается значение 1,25-1,29г/см3. Разница таких показателей между банками не должна превышать 0,1.
Если измерение этого показателя является ниже нормы, нужно повысить плотность электролита в аккумуляторе.
При помощи спринцовки из каждой банки выкачивается раствор. При этом набирать нужно как можно большее количество жидкости, измеряя ее объем, чтобы затем долить точно такое же количество свежего электролита.
Залив столько же свежего раствора, сколько было извлечено старого, АКБ хорошенько прокачивается с целью размешивания нового и старого электролита.
После этого снова проводиться измерение этого показателя: если он все еще находиться ниже нормы, все действия повторяются до достижения нужного значения плотности. По завершению при необходимости в банки автомобильной батареи добавляется дистиллированная вода.
Плотность ниже минимального значения
Бывают такие случаи, когда уровень этого показателя опускается ниже отметки 1,18.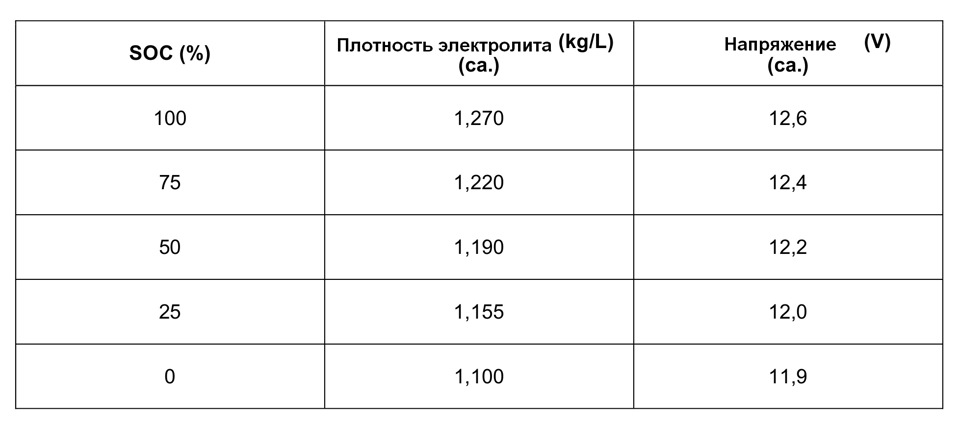 В таком случае вышеописанный способ ничем не поможет.
В таком случае вышеописанный способ ничем не поможет.
Чтобы восстановить работоспособность аккумуляторной батареи, вместо электролитического раствора нужно использовать кислоту, плотность которой выше, чему у электролита. При этом все действия проводятся точно так же, как и в предыдущем случае до того времени, пока показатель не придет в норму.
Можно ли повысить минимальную плотность?
Если уровень плотности раствора, что проводит ток в АКБ автомобиля упал намного ниже 1,18 г/см3, поднимать ее нет никакого смысла. В таком случае необходимо слить весь раствор, заменив его свежим.
Сначала с банок откачивается с помощью спринцовки как можно больше электролита. Далее батарея помещается в большую емкость, аккуратно переворачивается на бок, в дне каждой банки просверливается небольшое отверстие. Перевернув прибор, с него сливаются все излишки оставшейся жидкости.
Далее через крышки банок заливается дистиллированная вода с целью их промывания. После этого проделанные отверстия запаиваются пластмассой, стойкой к воздействию электролитической жидкости.
После этого проделанные отверстия запаиваются пластмассой, стойкой к воздействию электролитической жидкости.
Сделав это, в АКБ заливается свежий раствор, после чего прибор будет готов к использованию. Недостатком подобного способа является то, что в конечном результате снижается срок службы устройства, но некоторое время оно все еще поработает до покупки нового.
Как повысить при помощи зарядного устройстваТут также все просто, нам нужно заряжать аккумулятор на слабом токе, длительный промежуток времени. Суть такова, при достижении полного заряда, электролит начнет кипеть, пойдут пузырьки, это распадается и испаряется вода. Для повышения плотности нам нужно чтобы лишняя вода испарилась, а кислота осталась. Конечно, будет понижаться уровень в батареи – но вместо ушедшего уровня, добавляем нужный плотности электролит. Процесс этот долгий и муторный (выкипание — добавление), но примерно через пару суток можно догнать уже до плотности в 1,27 – 1,29 г/см3, что уже нормально.
Как видите повысить плотность можно, причем делается этот процесс зачастую своими руками, но разным способами — выбирайте свой, нужный вам.
Сейчас небольшое, но полезное видео.
А на этом у меня все, читайте наш АВТОБЛОГ.
(27 голосов, средний: 4,07 из 5)
Похожие новости
Сколько свинца в аккумуляторе. Разбираем автомобильные варианты .
Что такое AGM аккумулятор? 8 принципиальных отличий этой техноло.
Как проверить утечку тока в автомобиле. Мультиметром или попрост.
Добавить комментарий
Отменить ответДоброго всем дня, решил я написать свой отзыв о Toyota Avensis 2010 года. Просто хочу…
ТОП статей за месяц
У меня есть много различных статей и видео по различным коробкам передач, например вот здесь…
У меня на сайте уже есть статья про выбор карт памяти (можете посмотреть здесь), очень…
В статье – можно ли открывать окна при работающем кондиционере (почитать можно здесь), мне задали…
Как повысить плотность электролита в аккумуляторе в домашних условиях?
Электролит — это аккумуляторная жидкость, состоящая в идеальной концентрации из 35 процентов серной кислоты и 65% дистиллированной воды. На нашем портале vodi.su мы уже приводили таблицу, в которой указана оптимальная плотность электролита в АКБ. Если вы покупали стартерную батарею в магазине, продавец-консультант обязан был измерить плотность электролита, а также проверить АКБ под нагрузкой. Именно таким образом можно выявить заводской брак.
На нашем портале vodi.su мы уже приводили таблицу, в которой указана оптимальная плотность электролита в АКБ. Если вы покупали стартерную батарею в магазине, продавец-консультант обязан был измерить плотность электролита, а также проверить АКБ под нагрузкой. Именно таким образом можно выявить заводской брак.
Плотность электролита может изменяться в небольших пределах. Однако если вы ее измеряете ареометром при температуре воздуха 20–25 градусов и при полной зарядке АКБ, она должна составлять 1,27–1,28 г/см. куб. Но по разным причинам плотность может понижаться.
Почему это происходит:
- концентрация серной кислоты не соответствует установленным требованиям из-за регулярной доливки дистиллированной воды;
- разряд батареи;
- частые подзарядки, приводящие к закипанию электролита, испарению воды и части кислоты;
- выплескивание электролита и его утечка из-за механических повреждений корпуса аккумуляторной батареи.
Отметим, что при закипании электролита испаряется в основном вода. Температура кипения серной кислоты превышает 300 градусов. Даже если АКБ полностью заряжена, плотность электролита в разных банках может немного отличаться из-за разной концентрации. По этой причине не рекомендуется доливать электролит, а лишь воду в равных дозах в каждую банку.
Температура кипения серной кислоты превышает 300 градусов. Даже если АКБ полностью заряжена, плотность электролита в разных банках может немного отличаться из-за разной концентрации. По этой причине не рекомендуется доливать электролит, а лишь воду в равных дозах в каждую банку.
Как поднять плотность электролита?
Производители аккумуляторных батарей рекомендуют регулярно проводить замеры плотности хотя бы два раза в год во время сезонного обслуживания автомобилей. Если особых нареканий на работу АКБ нет, при падении плотности его достаточно подзарядить. О зарядке мы также ранее писали на нашем портале vodi.su. Если же уровень жидкости в банках понизился, нужно долить немного воды, чтобы она на 15–20 миллиметров покрывала пластины. При таком подходе кислота перемешается с водой в процессе работы двигателя.
Плотность электролита зависит от двух параметров:
- температура окружающего воздуха;
- концентрация серной кислоты.
Казалось бы, если плотность упала, нужно попросту добавить серной кислоты или готового электролита. Но это заблуждение, поскольку более высокая концентрация кислоты приводит к быстрой сульфатации пластин и их осыпанию. Соответственно, аккумулятор будет стремительно терять заряд, а все последующие подзарядки только приблизят его «кончину». Более того, если аккумулятор длительно эксплуатируется с пониженной плотностью, что говорит о снижении доли серной кислоты, это тоже дорога к его скорейшему выходу из строя.
Но это заблуждение, поскольку более высокая концентрация кислоты приводит к быстрой сульфатации пластин и их осыпанию. Соответственно, аккумулятор будет стремительно терять заряд, а все последующие подзарядки только приблизят его «кончину». Более того, если аккумулятор длительно эксплуатируется с пониженной плотностью, что говорит о снижении доли серной кислоты, это тоже дорога к его скорейшему выходу из строя.
Таким образом, если вы столкнулись с тем, что плотность электролита упала, предпринимать необходимо следующие шаги:
- Попытаться узнать причину изменения данного параметра — возможно, плотность (а с нею и уровень заряда) падали из-за того, что вы забыли на ночь выключить фары или имеются утечки тока;
- Зарядить полностью АКБ до указанных производителем значений и вновь измерить плотность;
- Внимательно проинспектировать корпус батареи на предмет наличия механических повреждений и отверстий.
У аккумуляторщиков есть свои секреты, как довести плотность до оптимальных показателей. Для этого они ставят АКБ на зарядку на срок от 12 часов до трех суток и заряжают слабыми токами не более 0,5 от емкости батареи. При этом замеряют плотность через равные временные промежутки. В идеале, если нет каких-то дефектов в виде отслоения пластин и осыпания активной массы свинца, заряженная батарея будет нормально работать длительное время. Естественно, нужно будет обязательно провести диагностику электрической цепи для выявления утечек тока.
Для этого они ставят АКБ на зарядку на срок от 12 часов до трех суток и заряжают слабыми токами не более 0,5 от емкости батареи. При этом замеряют плотность через равные временные промежутки. В идеале, если нет каких-то дефектов в виде отслоения пластин и осыпания активной массы свинца, заряженная батарея будет нормально работать длительное время. Естественно, нужно будет обязательно провести диагностику электрической цепи для выявления утечек тока.
Радикальный способ повысить плотность электролита в АКБ
Если плотность упала из-за того, что произошла утечка электролитического раствора, придется выравнивать его концентрацию во всех банках старым методом — путем слива старой жидкости и заливки новой. Отметим, что иногда к этому методу прибегают и в случае полной отработки ресурса и падения плотности до 1 грамма на см. куб.
Выполняется данная операция по следующему алгоритму:
- производим демонтаж аккумулятора и относим его в хорошо проветриваемое помещение с температурой воздуха не ниже 15 градусов;
- используя грушу, откачиваем электролитическую жидкость из каждой банки;
- полностью выкачать электролит грушей не получится, поэтому АКБ кладут набок и сверлят отверстия в днище каждой из банок и сливают остатки жидкости;
- промывают внутреннюю часть батареи дистиллированной водой.

Просверленные отверстия запаивают паяльником или заклеивают специальным клеящим составом на основе пластика. Далее приступают к приготовлению электролита. Можно купить готовый корректирующий состав, либо заливать по отдельности сначала дистиллят, а затем кислоту (концентрированный раствор).
Обратите внимание — порядок заливки должен быть именно такой: сначала льют воду, затем кислоту. Если его нарушить, начнется химическая реакция и электролит закипит.
Напоминаем, что данная процедура будет уместна лишь в том случае, если вы точно знаете, что произошла утечка электролита или он полностью выработал свой ресурс, а АКБ не держит заряд. Но она не поможет, если произошла сульфатация.
Дальнейшие действия:
- встряхнуть немного батарею для размешивания;
- когда состав немного осядет, замеряют ареометром плотность — если она в пределах до 1,25 и нет разницы по банкам (не более 0,1 г/см. куб), то можно поставить АКБ на недолгую зарядку на два-три часа, либо сразу ставить на машину и проехать какое-то расстояние;
- если же разница между банками больше 0,1, проводят корректирующую зарядку.

Для проведения подобных манипуляций необходимо располагать зарядными устройствами и дополнительными инструментами. Кроме того, работа с кислотой опасна сама по себе: должна быть хорошая вентиляция, требуются защитные очки и перчатки. Поэтому, если у вас нет опыта, времени или желания вникать в эти технические подробности, лучше обратиться к профессионалам в автосервисный центр.
Загрузка…Поделиться в социальных сетях
Как самостоятельно поднять плотность в аккумуляторе / Сервис Газ Vip
Аккумулятор в автомобиле — это устройство, которое необходимо для запуска транспортного средства и поддержании в работоспособном состоянии систем, зависящих от электричества. Со временем характеристики электролита снижаются, и водитель сталкивается с вопросом, как поднять плотность в аккумуляторе.
Содержание статьи:
- Почему падает плотность в аккумуляторе?
- Какая плотность электролита должна быть в аккумуляторе?
- Как поднять плотность в аккумуляторе самостоятельно?
- После зарядки осталась низкая плотность электролита, что делать?
- Где установить ГБО в Одессе?
1.
 Почему падает плотность в аккумуляторе?
Почему падает плотность в аккумуляторе?Для нормальной работы батареи не нужно допускать разрядку ниже 50% и соблюдать высокие температуры, которые поддерживаются химическими процессами в электродах и электролитах. При недостатке уровень электролита восполняется дистиллированной водой.
Самыми частыми причинами снижения плотности раствора является:
- Низкая концентрация раствора при добавлении дистиллятора. С каждым таким добавлением, воды будет больше, а электролита меньше. Это чревато испарениями не только воды, но и электрической жидкости.
- Во время зарядки жидкость может закипать и выпариваться, из-за чего снижается уровень электролита, но при этом повышается его насыщенность. Ионизация свинца и соответствующих веществ происходит сложно, так как количество действующих молекул уменьшается. В конце концов жидкость теряет присущую ей плотность.
- Низкий заряд батареи.
Иногда зарядить севший аккумулятор не получается. Это признак того, что состояние электролита изменилось. Не знающие водители часто доливают в АКБ дистиллированную воду в больших объемах. И в этом состоит главная ошибка. Если дистиллята будет слишком много, то электролит выкипит, а плотность упадет.
Не знающие водители часто доливают в АКБ дистиллированную воду в больших объемах. И в этом состоит главная ошибка. Если дистиллята будет слишком много, то электролит выкипит, а плотность упадет.
Также причиной снижения плотности может быть глубокий разряд АКБ и его долгий срок хранения без подзарядки.
2. Какая плотность электролита должна быть в аккумуляторе?
Первое на что обращают внимание при первых же признаках неисправностей, это плотность электролита. Рабочая плотность в стартерных батареях должна быть около 1,24-1,30 г/см³. Ее измеряют специальным прибором под названием ареометр.
Когда аккумулятор разрядился, то плотность электролита снижается, а во время зарядки увеличивается. Именно поэтому плотность замеряют только на полностью заряженной батарее.
Важно! Для повышения плотности электролита можно добавлять серный концентрат. Но делается это предельно осторожно, т.к. при завышенной плотности начинают осыпаться пластины и портится АКБ.
3.
 Как поднять плотность в аккумуляторе самостоятельно?
Как поднять плотность в аккумуляторе самостоятельно?Если вы решили самостоятельно повысить плотность в аккумуляторе, то в первую очередь соблюдайте правила техники безопасности. В составе электролита присутствует действующая серная кислота и при попадании на кожу, она может разъесть ее.
Чтобы повысить плотность электролита в АКБ можно воспользоваться одним из представленных способов:
- Полностью заменить электролит на новую жидкость с нормальной концентрацией 1 г/куб. см;
- Залейте кислоту аккумулятора в электролит;
- Доведите имеющийся раствор до нужной концентрации. Этого достигают путем добавления серной кислоты и дистиллированной воды. Жидкость заливают до необходимой насыщенности.
Чтобы полностью заменить электролит следуют следующему плану:
- Откачивают имеющийся раствор и освобождают емкость. Это можно сделать с помощью груши.
- В каждой емкости АКБ проделывают отверстия для полного слива остатков электролита.

- Банки и емкости удерживают в наклоне и отмывают остатки старого раствора дистиллированной водой.
- Чистые батареи приводят в герметичное состояние. Для этого понадобится паяльная лампа и кислотная пластмасса. Ими заделывают сделанные ранее отверстия.
- Емкости наполняют дистиллятором в нужных пропорциях. Количество воды будет зависеть от общего объема емкости и необходимого количества кислоты. Концентрация должна рассчитываться на диапазон 1,25-1,27 г/куб. см.
- Емкость хорошо закрывают и встряхивают аккумуляторную батарею без сильного наклона.
Запомните! Для начала в банку заливается разбавляющее вещество — дистиллят. Только потом добавляется кислота. Если не соблюдать порядок, жидкости начнет кипеть.
4. После зарядки осталась низкая плотность электролита, что делать?
Если процедура по повышению плотности электролита была проведена грамотно, то срок эксплуатации АКБ должен увеличиться. Но процедура по повышению плотности электролита не всегда приводит к успеху. Например, это может быть связано с осыпанием пластин.
Например, это может быть связано с осыпанием пластин.
Даже если после проведения процедуры плотность раствора быстро сокращается и после зарядки не поднимается до нужного показателя, то придется задуматься о покупке новой АКБ.
Чтобы восстановить прежнюю плотность батареи нужно добавить в нее свежий раствор электролита. Плотность электролита поднимет более концентрированный раствор и тем самым улучшатся показатели в аккумуляторе.
Для начала измерьте показания плотности проблемных банок ареометром. Если показания равны или меньше 1,20, то батарее нужна подобная процедура. В обслуживаемых аккумуляторах имеются специальные отверстия, через которые можно долить электролит.
- Нужно откачать часть старого раствора грушей и добавить в него концентрированный электролит, например, плотностью 1,30.
- Затем перемешивают раствор в аккумуляторе и снова измеряют плотность.
- Если по-прежнему есть отклонения, то процедуру повторяют пока плотность не поднимется до нужного уровня.

- Если плотность слишком сильно поднялась, то снова откачивают часть электролита, но только теперь добавляют воду.
Также можно из аккумулятора сразу откачать весь электролит, а залить в аккумулятор отдельного подготовленный раствор с нужной плотностью.
Периодическая полная зарядка аккумулятора зарядным устройством поможет сохранить его в полной работоспособности.
5. Где установить ГБО в Одессе?
Установить ГБО в Одессе можно в сервисных центрах Сервис Газ. Мы работаем с европейским оборудованием итальянского и польского производства. Все сотрудники имеют большой опыт работы в сфере установки газобаллонного оборудования.
У нас можно не только установить газ на авто, но и сделать полное техническое обслуживание газовых систем, провести ремонт, настройку и замену запчастей, которые уже выходят из строя.
Приезжайте к нам вовремя, чтобы ваше транспортное средство всегда было на ходу.
Рекомендуем посмотреть видео:
youtube.com/embed/YRCVKTHPYNA»/>
24.11.2020
(285 просмотров)
Как увеличить плотность электролита в АКБ? — 130.com.ua
Практически все автовладельцы не обращают внимания на аккумулятор до первых проблем. Именно наша безответственность быстро приводит к моментам поломки, когда машина уже просто отказывается заводиться. Самая частая причина — разрядка аккумулятора.
Кстати, даже новый аккумулятор может помешать вашей поездке. Есть доля вероятности купить не совсем качественный аппарат. Что под этим подразумевается? Чаще всего: не полностью заряженный аккумулятор или недостаток электролита.Такие нюансы не проверять во время покупки.
Основные способы
Как только аккумулятор отказывается работать, ставим на зарядку. Но что мы видим: цикл зарядки прошел, а батарея все еще разряжена. Возникла новая проблема-аккумулятор просто не держит заряд. Здесь нужно выяснить причины, по которым это происходит.
Чаще всего это происходит с батареями, которые были посажены на 0. Здесь появляется новая задача — проверить на сколько разряжена батарея.Сначала проверьте плотность электролита с помощью специального прибора — кислотометра.
Здесь появляется новая задача — проверить на сколько разряжена батарея.Сначала проверьте плотность электролита с помощью специального прибора — кислотометра.
Делаем так:
- Установите измеритель кислоты в любой аккумуляторный блок.
- Шкала ареометра покажет плотность электролита.
- Сравните полученные значения с табличными параметрами плотности.
Если вы живете в регионе с суровым климатом, то значение будет примерно 1,25 кг / л. Здесь имейте в виду, что разница в плотности между двумя банками не должна быть больше 0.01.
Как поднять плотность?
Способ решения этой проблемы зависит от того, какие значения вы получите.
Плотность 1,18-1,20 кг / литр
Грушей откачиваем старый электролит: максимально. Наполните новую до половины откачанного вами объема. Условно, например: закачивают 1 кг., Наливают 0,5 кг. Здесь нужно добиться нормы плотности электролита, а остальное долить дистиллированной водой.
Плотность менее 1.18 кг / литр
В этом случае нужно использовать аккумуляторную кислоту. Делаем все так же, как и в первом случае, но вполне вероятно, что процедуру придется повторить. Ваша основная задача остается прежней — получить значение нормы.
Плотность очень низкая
К сожалению, тут придется полностью менять электролит для экономии аккумулятора. С помощью груши нужно будет максимально откачать старый электролит, а банки закрыть пробками.И дальше этого плана придерживаются:
- После закручивания заглушек положить аккумулятор на бок. Берем сверло 3 мм. или 3,5 мм. и проделайте одно отверстие на дне банки. Итак, мы можем полностью слить электролит.
- Промойте все банки дистиллированной водой. Отверстия закрыты кислотостойким пластиком. Итак, мы сделали все необходимое, чтобы подготовить емкость для нового электролита.
- Приготовьте электролит самостоятельно. Возьмите дистиллированную воду и налейте в нее аккумуляторную кислоту.
 Обратите внимание, обратный порядок не допускается, то есть в кислоту нельзя заливать воду. Не забудьте надеть резиновые перчатки.
Обратите внимание, обратный порядок не допускается, то есть в кислоту нельзя заливать воду. Не забудьте надеть резиновые перчатки.
В результате вы должны получить значения электролита, необходимые для вашего региона. Если по каким-то причинам не удалось увеличить плотность электролита, придется выбрать новый аккумулятор. Купить аккумулятор с доставкой по Украине в Харьков, Киев, Одессу можно на 130.com.ua.
Материалы по теме
Оптимизация максимальной удельной плотности энергии литий-ионной батареи с использованием метода поверхности с прогрессивным квадратичным откликом и плана экспериментов
Литий-ионные батареи (LIB) широко используются в качестве перезаряжаемых батарей из-за их высокой теоретической плотности энергии и длительного срока службы.Спрос на LIB высокой мощности и большой емкости резко вырос из-за растущего спроса на электромобили и устройства хранения энергии 1,2,3 . Чтобы удовлетворить эту тенденцию, необходимо повысить плотность энергии LIB. Для этого исследуются и разрабатываются новые электродные материалы. Однако разработка новых электродных материалов требует значительного времени и усилий; поэтому многие исследователи в настоящее время проводят исследования по этому же вопросу.
Для этого исследуются и разрабатываются новые электродные материалы. Однако разработка новых электродных материалов требует значительного времени и усилий; поэтому многие исследователи в настоящее время проводят исследования по этому же вопросу.
Таким образом, одним из способов снижения затрат на исследования и разработки является оптимизация конструктивных параметров существующих электродных материалов, таких как пористость и толщина, для увеличения мощности и емкости LIB 4,5,6,7,8,9 , 10,11,12,13,14,15 .Крайне важно оптимизировать переменные конструкции для достижения целевой производительности, поскольку мощность и емкость имеют компромиссное соотношение. Однако связь между конструктивными параметрами и характеристиками литий-ионных батарей очень нелинейна; поэтому их сложно сконструировать экспериментально. Для преодоления этих трудностей используется оптимизация с использованием численных моделей, учитывающих электрохимические реакции, что является эффективным методом. Недавние исследования были проведены для оптимизации переменных конструкции элементов с использованием численных моделей для проектирования батарей большой мощности / большой емкости 4 .
Недавние исследования были проведены для оптимизации переменных конструкции элементов с использованием численных моделей для проектирования батарей большой мощности / большой емкости 4 .
Ранее Ньюман провел параметрическое исследование с использованием графика Рагона, чтобы максимизировать удельную плотность энергии батареи 5,6,7,8,9,10,11 . График Рагона — это простой график, который показывает взаимосвязь между удельной энергией и удельной мощностью клетки. Дойл и др. разработал электрохимическую модель для прогнозирования характеристик заряда и разряда батареи с использованием теории пористого электрода и теории концентрированного раствора. Это послужило основой для последующих исследований по оптимизации LIB 5 .Путем параметрического исследования Дойл и Ньюман сравнили удельную плотность энергии ячеек, состоящих из электродов разной толщины, пористости и электролитов, и предложили оптимизированную ячейку с использованием графика Рагона 6,7,8 .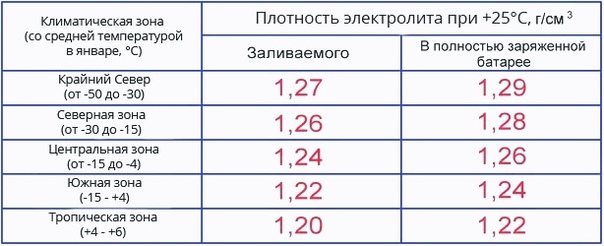 Шринивасан и Ньюман оптимизировали пористость и толщину положительного электрода для различных скоростей C, сохранив при этом соотношение емкостей двух электродов, толщину и пористость сепаратора, а также пористость отрицательного электрода 9 .Christensen et al. оптимизировали толщину и пористость отрицательных электродов из титаната лития (LTO) для электромобилей и использовали график Рагона для прогнозирования энергетических характеристик 10 . Стюарт и др. улучшен график Рагона с учетом импульсных характеристик гибридного электромобиля (HEV) и оптимизировано удельное соотношение мощности к энергии аккумуляторной батареи HEV 11 . Appiah et al. оптимизировали толщину и пористость LiNi 0,6 Co 0,2 Mn 0.2 O 2 катода посредством параметрического исследования с использованием графика Рагона 12 . Однако получение оптимальных переменных с использованием графика Рагона и параметрического исследования может быть дорогостоящим в вычислительном отношении; поэтому необходимы исследования с использованием методов численной оптимизации.
Шринивасан и Ньюман оптимизировали пористость и толщину положительного электрода для различных скоростей C, сохранив при этом соотношение емкостей двух электродов, толщину и пористость сепаратора, а также пористость отрицательного электрода 9 .Christensen et al. оптимизировали толщину и пористость отрицательных электродов из титаната лития (LTO) для электромобилей и использовали график Рагона для прогнозирования энергетических характеристик 10 . Стюарт и др. улучшен график Рагона с учетом импульсных характеристик гибридного электромобиля (HEV) и оптимизировано удельное соотношение мощности к энергии аккумуляторной батареи HEV 11 . Appiah et al. оптимизировали толщину и пористость LiNi 0,6 Co 0,2 Mn 0.2 O 2 катода посредством параметрического исследования с использованием графика Рагона 12 . Однако получение оптимальных переменных с использованием графика Рагона и параметрического исследования может быть дорогостоящим в вычислительном отношении; поэтому необходимы исследования с использованием методов численной оптимизации.
Например, Xue et al. отобрали 12 проектных переменных, включая пористость электрода, коэффициент диффузии и различные коэффициенты углерода, и рассчитали градиент с помощью метода комплексной ступенчатой аппроксимации. Затем они оптимизировали удельную плотность энергии, используя методы последовательного квадратичного программирования 13 .Golmon et al. разработали многомасштабную модель батареи, которая дополнительно учитывала микромасштаб, использовала сопутствующий анализ чувствительности для расчета градиента и оптимизировала емкость батареи 14 . Чанхонг Лю и Линь Лю оптимизировали потерю емкости аккумулятора с помощью алгоритма на основе градиента, называемого поиском нескольких начальных точек, и улучшили потерю емкости аккумулятора на 22%. 15 . Однако оптимизация на основе градиента — это сложный процесс, требующий различных этапов вычислений и времени.Более того, он чувствителен к числовому шуму, и результаты оптимизации сходятся к локальному оптимуму 16 .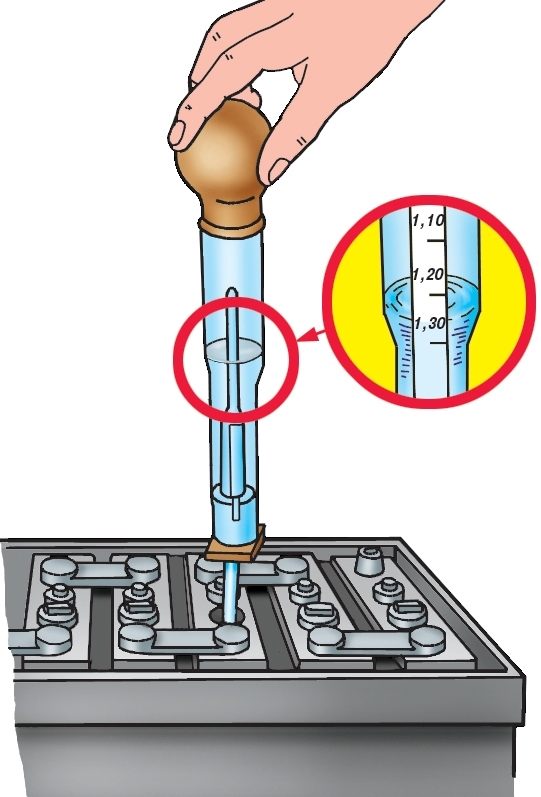
Чтобы избежать недостатков оптимизации на основе градиента, исследователи изучили множество алгоритмов, которые не требуют вычисления градиента 17,18,19 . Среди них метод поверхности прогрессивного квадратичного отклика (PQRSM) является одним из методов последовательной приближенной оптимизации (SAO), который может быть эффективно применен к нелинейным задачам без градиентных вычислений 20 .Кроме того, PQRSM применяет алгоритм доверительной области, который гарантирует слабую глобальную сходимость и имеет низкую вероятность сходимости на локальном оптимуме 21,22,23 . Кроме того, в отличие от параметрического исследования с использованием графика Рагона, которое требует сотен симуляций для анализа одной ячейки, PQRSM требует меньше вычислений для получения оптимальных результатов. Для этих преимуществ PQRSM используется в различных областях техники; однако он никогда не применялся для оптимизации LIB 24,25 .
В этом исследовании оптимизация максимальной удельной плотности энергии ячейки LIB выполняется с использованием плана экспериментов, PQRSM и электрохимической модели LIB, которая используется для расчета удельной плотности энергии и удельной плотности мощности. Во-первых, план экспериментов (DOE) был проведен для анализа чувствительности восьми факторов конструкции ячейки, включая толщину анода, толщину катода, толщину сепаратора, пористость анода, пористость катода, пористость сепаратора, размер частиц анода и размер частиц катода.Расчетные факторы, чувствительные к удельной плотности энергии и удельной мощности, были выбраны в качестве проектных переменных посредством анализа чувствительности DOE. PQRSM, который гарантирует слабую глобальную сходимость и не требует вычисления градиента, использовался в качестве алгоритма оптимизации для максимизации удельной плотности энергии LIB. После оптимизации различия в удельной плотности энергии и удельной плотности мощности исходной и оптимизированной ячейки сравнивались с помощью разряда постоянного тока.Он подтвердил превосходство оптимизированного результата дизайна.
Во-первых, план экспериментов (DOE) был проведен для анализа чувствительности восьми факторов конструкции ячейки, включая толщину анода, толщину катода, толщину сепаратора, пористость анода, пористость катода, пористость сепаратора, размер частиц анода и размер частиц катода.Расчетные факторы, чувствительные к удельной плотности энергии и удельной мощности, были выбраны в качестве проектных переменных посредством анализа чувствительности DOE. PQRSM, который гарантирует слабую глобальную сходимость и не требует вычисления градиента, использовался в качестве алгоритма оптимизации для максимизации удельной плотности энергии LIB. После оптимизации различия в удельной плотности энергии и удельной плотности мощности исходной и оптимизированной ячейки сравнивались с помощью разряда постоянного тока.Он подтвердил превосходство оптимизированного результата дизайна.
Новый метод увеличения плотности энергии в литиевых батареях
Во время первой зарядки литиевой батареи после ее изготовления часть жидкого электролита превращается в твердую фазу и наносится на отрицательный электрод батареи. Этот процесс, обычно выполняемый до отправки аккумуляторов с завода, необратим и снижает запас энергии в аккумуляторе. Потери составляют примерно 10% для современных отрицательных электродов, но могут достигать 20-30% для отрицательных электродов следующего поколения с высокой емкостью, таких как кремний, поскольку эти материалы имеют большое объемное расширение и высокую площадь поверхности.Большие начальные потери уменьшают достижимую емкость в полной ячейке и, таким образом, ставят под угрозу выигрыш в плотности энергии и сроке службы этих наноструктурированных электродов.
Этот процесс, обычно выполняемый до отправки аккумуляторов с завода, необратим и снижает запас энергии в аккумуляторе. Потери составляют примерно 10% для современных отрицательных электродов, но могут достигать 20-30% для отрицательных электродов следующего поколения с высокой емкостью, таких как кремний, поскольку эти материалы имеют большое объемное расширение и высокую площадь поверхности.Большие начальные потери уменьшают достижимую емкость в полной ячейке и, таким образом, ставят под угрозу выигрыш в плотности энергии и сроке службы этих наноструктурированных электродов.
Традиционный подход к компенсации этих потерь заключался в помещении в электрод определенных материалов, богатых литием. Однако большинство этих материалов нестабильны в окружающем воздухе. Производство аккумуляторов в сухом воздухе, в котором совсем нет влаги, — намного более дорогой процесс, чем производство на воздухе.Ян разработал новую трехслойную структуру электрода для изготовления анодов литиированных батарей в окружающем воздухе. В этих электродах он защитил литий слоем полимера ПММА, чтобы предотвратить реакцию лития с воздухом и влагой, а затем покрыл ПММА такими активными материалами, как искусственный графит или наночастицы кремния. Затем слой ПММА растворялся в электролите батареи, подвергая литий воздействию электродных материалов. «Таким образом, мы смогли избежать любого контакта с воздухом между нестабильным литием и литиированным электродом, — объясняет Ян, — поэтому трехслойный электрод может работать в окружающем воздухе.Это могло бы стать привлекательным шагом вперед на пути к массовому производству электродов для литиевых батарей ».
В этих электродах он защитил литий слоем полимера ПММА, чтобы предотвратить реакцию лития с воздухом и влагой, а затем покрыл ПММА такими активными материалами, как искусственный графит или наночастицы кремния. Затем слой ПММА растворялся в электролите батареи, подвергая литий воздействию электродных материалов. «Таким образом, мы смогли избежать любого контакта с воздухом между нестабильным литием и литиированным электродом, — объясняет Ян, — поэтому трехслойный электрод может работать в окружающем воздухе.Это могло бы стать привлекательным шагом вперед на пути к массовому производству электродов для литиевых батарей ».
Янга снизил потери в современных графитовых электродах с 8% до 0,3%, а в кремниевых электродах с 13% до -15%. Цифра -15% указывает на то, что лития было больше, чем необходимо, и «лишний» литий можно использовать для дальнейшего увеличения срока службы батарей, поскольку избыток может компенсировать потерю емкости в последующих циклах. Поскольку плотность энергии или емкость литий-ионных аккумуляторов увеличивалась на 5-7% ежегодно за последние 25 лет, результаты Янга указывают на возможное решение для увеличения емкости литий-ионных аккумуляторов. Его группа сейчас пытается уменьшить толщину полимерного покрытия, чтобы оно занимало меньший объем в литиевой батарее, и расширить его технику.
Его группа сейчас пытается уменьшить толщину полимерного покрытия, чтобы оно занимало меньший объем в литиевой батарее, и расширить его технику.
«Эта трехслойная структура электрода действительно представляет собой продуманную конструкцию, которая позволяет обрабатывать литий-металлсодержащие электроды в условиях окружающей среды», — отмечает Хайлианг Ван, доцент химии Йельского университета, который не принимал участия в исследовании. «Первоначальная кулоновская эффективность электродов — большая проблема для индустрии литий-ионных аккумуляторов, и этот эффективный и простой в использовании метод компенсации необратимых потерь ионов лития вызовет интерес.”
Исследование получило стартовое финансирование от Columbia Engineering и дополнительную поддержку Центра устойчивой энергетики Ленфест.
Понимание ограничивающих факторов производительности толстых электродов применительно к литий-ионным батареям с высокой плотностью энергии (Журнальная статья)
Ду, Чжицзя, Вуд, Дэвид Л. , Даниэль, Клаус, Калнаус, Сергей и Ли, Цзяньлинь. Понимание ограничивающих факторов в работе толстых электродов применительно к литий-ионным батареям с высокой плотностью энергии .США: Н. П., 2017.
Интернет. DOI: 10.1007 / s10800-017-1047-4.
, Даниэль, Клаус, Калнаус, Сергей и Ли, Цзяньлинь. Понимание ограничивающих факторов в работе толстых электродов применительно к литий-ионным батареям с высокой плотностью энергии .США: Н. П., 2017.
Интернет. DOI: 10.1007 / s10800-017-1047-4.
Ду, Чжицзя, Вуд, Дэвид Л., Даниэль, Клаус, Калнаус, Сергей и Ли, Цзяньлинь. Понимание ограничивающих факторов в работе толстых электродов применительно к литий-ионным батареям с высокой плотностью энергии . Соединенные Штаты. https://doi.org/10.1007/s10800-017-1047-4
Ду, Чжицзя, Вуд, Дэвид Л., Даниэль, Клаус, Калнаус, Сергей и Ли, Цзяньлинь. Чт.
«Понимание ограничивающих факторов в работе толстых электродов применительно к литий-ионным батареям с высокой плотностью энергии». Соединенные Штаты. https://doi.org/10.1007/s10800-017-1047-4. https://www.osti.gov/servlets/purl/1346648.
https://www.osti.gov/servlets/purl/1346648.
@article {osti_1346648,
title = {Понимание факторов, ограничивающих характеристики толстых электродов применительно к литий-ионным батареям с высокой плотностью энергии},
author = {Ду, Чжицзя и Вуд, Дэвид Л.and Daniel, Claus and Kalnaus, Sergiy and Li, Jianlin},
abstractNote = {Мы представляем, что увеличение толщины электродов, тем самым увеличивая объемную долю активных материалов, является одним из эффективных методов, позволяющих разработать литий-ионные батареи с высокой плотностью энергии. В данном исследовании оптимизация зависимости плотности энергии от плотности мощности батареи LiNi0,8Co0,15Al0,05O2 (NCA) / графитовых ячеек была проведена с помощью математического моделирования. Было обнаружено, что плотность энергии имеет максимальную точку в зависимости от толщины электрода (критической толщины) при заданной скорости разряда C. Было обнаружено, что физическими факторами, ограничивающими плотность энергии / мощности толстых электродов, являются повышенная поляризация ячеек и недоиспользование активных материалов. На последний влияет диффузия Li-иона в активных материалах и истощение Li-иона в фазе электролита. На основе этих результатов были выработаны возможные подходы к преодолению ограничивающих факторов. Наконец, улучшение соотношения энергии и мощности в ячейке 18 650 использовалось для демонстрации того, как оптимизировать параметры толстого электрода при разработке элементов.},
Было обнаружено, что физическими факторами, ограничивающими плотность энергии / мощности толстых электродов, являются повышенная поляризация ячеек и недоиспользование активных материалов. На последний влияет диффузия Li-иона в активных материалах и истощение Li-иона в фазе электролита. На основе этих результатов были выработаны возможные подходы к преодолению ограничивающих факторов. Наконец, улучшение соотношения энергии и мощности в ячейке 18 650 использовалось для демонстрации того, как оптимизировать параметры толстого электрода при разработке элементов.},
doi = {10.1007 / s10800-017-1047-4},
url = {https://www.osti.gov/biblio/1346648},
journal = {Журнал прикладной электрохимии},
issn = {0021-891X},
число = 3,
объем = 47,
place = {United States},
год = {2017},
месяц = {2}
}
На пути к недорогим литий-ионным батареям с высокой плотностью энергии и высокой плотностью энергии (Журнальная статья)
Ли, Цзяньлинь, Ду, Чжицзя, Рутер, Роуз Э. , Ан, Сеонг Джин, Дэвид, Ламуэль Абрахам, Хейс, Кевин, Вуд, Марисса, Филипп, Натан Д., Шэн, Янпин, Мао, Чэнью, Калнаус, Сергей, Даниэль, Клаус и Вуд, III, Дэвид Л. К недорогим литий-ионным батареям с высокой плотностью энергии и высокой плотностью энергии . США: Н. П., 2017.
Интернет. DOI: 10.1007 / s11837-017-2404-9.
, Ан, Сеонг Джин, Дэвид, Ламуэль Абрахам, Хейс, Кевин, Вуд, Марисса, Филипп, Натан Д., Шэн, Янпин, Мао, Чэнью, Калнаус, Сергей, Даниэль, Клаус и Вуд, III, Дэвид Л. К недорогим литий-ионным батареям с высокой плотностью энергии и высокой плотностью энергии . США: Н. П., 2017.
Интернет. DOI: 10.1007 / s11837-017-2404-9.
Ли, Цзяньлинь, Ду, Чжицзя, Рутер, Роуз Э., Ан, Сеонг Джин, Дэвид, Ламюэль Абрахам, Хейс, Кевин, Вуд, Марисса, Филипп, Натан Д., Шэн, Янпин, Мао, Чэнью, Калнаус, Сергей, Даниэль, Клаус и Вуд, III, Дэвид Л. К недорогим литий-ионным батареям с высокой плотностью энергии и высокой плотностью энергии . Соединенные Штаты. https://doi.org/10.1007/s11837-017-2404-9
Ли, Цзяньлинь, Ду, Чжицзя, Рутер, Роуз Э., Ан, Сон Джин, Дэвид, Ламюэль Абрахам, Хейс, Кевин, Вуд, Марисса, Филипп, Натан Д.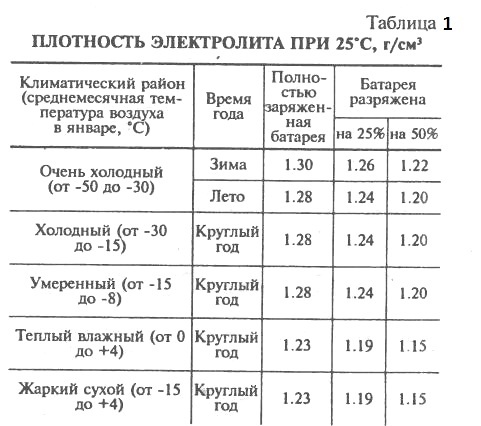 , Шэн, Янпин, Мао, Чэнъюй, Калнаус, Сергей, Даниэль, Клаус и Вуд, III, Дэвид Л. Мон.
«К недорогим литий-ионным батареям с высокой плотностью энергии и высокой плотностью энергии». Соединенные Штаты. https://doi.org/10.1007/s11837-017-2404-9. https://www.osti.gov/servlets/purl/1400215.
, Шэн, Янпин, Мао, Чэнъюй, Калнаус, Сергей, Даниэль, Клаус и Вуд, III, Дэвид Л. Мон.
«К недорогим литий-ионным батареям с высокой плотностью энергии и высокой плотностью энергии». Соединенные Штаты. https://doi.org/10.1007/s11837-017-2404-9. https://www.osti.gov/servlets/purl/1400215.
@article {osti_1400215,
title = {К недорогим литий-ионным батареям с высокой плотностью энергии и высокой плотностью энергии},
author = {Ли, Цзяньлинь и Ду, Чжицзя и Рутер, Роуз Э.и Ан, Сон Джин и Дэвид, Ламуэль Абрахам и Хейс, Кевин и Вуд, Марисса и Филипп, Натан Д. и Шэн, Янпин и Мао, Чэнью и Калнаус, Сергей и Даниэль, Клаус и Вуд, III, Дэвид Л.},
abstractNote = {Снижение стоимости и увеличение плотности энергии - два препятствия на пути широкого применения литий-ионных батарей в электромобилях. Хотя стоимость аккумуляторов для электромобилей с 2008 по 2015 год снизилась примерно на 70%, текущая стоимость аккумуляторных батарей (268 / кВтч в 2015 году) все еще в 2 раза больше, чем запланировано USABC (125 / кВтч). Несмотря на то, что многие достижения в химии элементов были реализованы с тех пор, как литий-ионная батарея была впервые коммерциализирована в 1991 году, за последнее десятилетие произошло несколько крупных достижений. Следовательно, будущее снижение затрат будет зависеть от производства ячеек и более широкого признания рынка. В этой статье обсуждаются три основных аспекта снижения затрат: (1) контроль качества для минимизации брака при производстве элементов; (2) новая обработка электродов и инженерия для снижения стоимости обработки и увеличения плотности энергии и производительности; и (3) разработка и оптимизация материалов для литий-ионных батарей с высокой плотностью энергии.Также рассматриваются идеи по увеличению энергии и удельной мощности литий-ионных батарей.},
Несмотря на то, что многие достижения в химии элементов были реализованы с тех пор, как литий-ионная батарея была впервые коммерциализирована в 1991 году, за последнее десятилетие произошло несколько крупных достижений. Следовательно, будущее снижение затрат будет зависеть от производства ячеек и более широкого признания рынка. В этой статье обсуждаются три основных аспекта снижения затрат: (1) контроль качества для минимизации брака при производстве элементов; (2) новая обработка электродов и инженерия для снижения стоимости обработки и увеличения плотности энергии и производительности; и (3) разработка и оптимизация материалов для литий-ионных батарей с высокой плотностью энергии.Также рассматриваются идеи по увеличению энергии и удельной мощности литий-ионных батарей.},
doi = {10.1007 / s11837-017-2404-9},
url = {https://www.osti.gov/biblio/1400215},
журнал = {JOM. Журнал Общества минералов, металлов и материалов},
issn = {1047-4838},
число = 9,
объем = 69,
place = {United States},
год = {2017},
месяц = {6}
}
Влияние количества электролита на литий-ионные элементы
В производственной цепочке литий-ионных аккумуляторных элементов процесс заполнения имеет первостепенное значение для качества конечного продукта и затрат. Заливка состоит из нескольких этапов дозирования жидкого электролита в ячейку и последующего (промежуточного) смачивания компонентов ячейки. Количество залитого электролита не только влияет на скорость смачивания электродов и сепаратора, но также ограничивает емкость ячейки и влияет на срок службы батареи. Однако слишком много электролита является мертвым грузом, приводит к более низкой плотности энергии и излишне увеличивает стоимость батареи. Для обеспечения низких затрат на производство и в то же время высокого качества ячеек в данной статье исследуется оптимальное количество электролита.На основе экспериментальных данных спектроскопии электрохимического импеданса, процесса заполнения, процесса формирования, а также испытания на срок службы представлены зависимости между количеством электролита, скоростью смачивания, емкостью, плотностью энергии и сроком службы для крупноформатных ячеек.
Заливка состоит из нескольких этапов дозирования жидкого электролита в ячейку и последующего (промежуточного) смачивания компонентов ячейки. Количество залитого электролита не только влияет на скорость смачивания электродов и сепаратора, но также ограничивает емкость ячейки и влияет на срок службы батареи. Однако слишком много электролита является мертвым грузом, приводит к более низкой плотности энергии и излишне увеличивает стоимость батареи. Для обеспечения низких затрат на производство и в то же время высокого качества ячеек в данной статье исследуется оптимальное количество электролита.На основе экспериментальных данных спектроскопии электрохимического импеданса, процесса заполнения, процесса формирования, а также испытания на срок службы представлены зависимости между количеством электролита, скоростью смачивания, емкостью, плотностью энергии и сроком службы для крупноформатных ячеек.
Литий-ионные батареи (LIB) в качестве электрохимических систем хранения энергии являются ключевой технологией для замены ископаемого топлива и позволяют хранить возобновляемые ресурсы из-за их малого веса, высокой плотности энергии и длительного срока службы. 1 Эти батареи за последние три десятилетия заняли доминирующее положение в бытовой электронике и послужили толчком к успеху мобильных устройств, таких как сотовые телефоны и портативные компьютеры. Таким образом, ожидается, что рынок электротранспорта и стационарного хранения энергии будет активно стимулироваться LIB. 2 Цель более высокой плотности энергии в автомобильных приложениях может быть достигнута за счет уменьшения процентного содержания неактивных материалов, таких как фольга токосъемника, компоненты корпуса или разделители на элемент.Это способствует тенденции к увеличению размеров ячеек 3 , а также к более толстым электродам. 4 Ячейки большого формата, однако, создают проблемы для производственных процессов, таких как заполнение жидкими электролитами. Для обеспечения надежной работы и высокой производительности все полости и поры электродов и сепаратора необходимо смачивать перед началом цикла пласта. 5 В противном случае существует опасность образования неоднородной межфазной фазы твердого электролита (SEI), которая является продуктом реакции компонентов растворителя электролита и лития на поверхности анода.
1 Эти батареи за последние три десятилетия заняли доминирующее положение в бытовой электронике и послужили толчком к успеху мобильных устройств, таких как сотовые телефоны и портативные компьютеры. Таким образом, ожидается, что рынок электротранспорта и стационарного хранения энергии будет активно стимулироваться LIB. 2 Цель более высокой плотности энергии в автомобильных приложениях может быть достигнута за счет уменьшения процентного содержания неактивных материалов, таких как фольга токосъемника, компоненты корпуса или разделители на элемент.Это способствует тенденции к увеличению размеров ячеек 3 , а также к более толстым электродам. 4 Ячейки большого формата, однако, создают проблемы для производственных процессов, таких как заполнение жидкими электролитами. Для обеспечения надежной работы и высокой производительности все полости и поры электродов и сепаратора необходимо смачивать перед началом цикла пласта. 5 В противном случае существует опасность образования неоднородной межфазной фазы твердого электролита (SEI), которая является продуктом реакции компонентов растворителя электролита и лития на поверхности анода. 6 В то время как SEI на аноде создается во время этих начальных циклов зарядки и разрядки, межфазная фаза катодного электролита (CEI) является результатом старения при повышенных температурах или циклического воздействия высоких напряжений. 7 Преждевременная зарядка до полного смачивания может привести к сильным локальным колебаниям толщины слоя, которые могут вызвать частичное отрывание слоя. 8 Тогда, в отличие от реальной функции SEI, возможен перенос электронов от электрода к электролиту (восстановление электролита) и блокирование ионов, что отрицательно сказывается на емкости и сроке службы элемента. . 9
6 В то время как SEI на аноде создается во время этих начальных циклов зарядки и разрядки, межфазная фаза катодного электролита (CEI) является результатом старения при повышенных температурах или циклического воздействия высоких напряжений. 7 Преждевременная зарядка до полного смачивания может привести к сильным локальным колебаниям толщины слоя, которые могут вызвать частичное отрывание слоя. 8 Тогда, в отличие от реальной функции SEI, возможен перенос электронов от электрода к электролиту (восстановление электролита) и блокирование ионов, что отрицательно сказывается на емкости и сроке службы элемента. . 9
Увеличение числа слоев, толщины электрода и площади поверхности на ячейку еще больше снижает трудоемкое смачивание компонентов ячейки электролитом. 10 Небольшие поверхности в монетных элементах не представляют проблемы для смачивания, поскольку электролит может достичь всех полостей за короткое время. Однако при промышленном производстве ячеек большого формата выполняется несколько периодических циклов смачивания и формирования, в результате чего общая продолжительность составляет до 3 недель. 11 Это подразумевает значительные расходы, так как десятки тысяч циклов, а также складские помещения необходимы для управления требуемой пропускной способностью. 11
11 Это подразумевает значительные расходы, так как десятки тысяч циклов, а также складские помещения необходимы для управления требуемой пропускной способностью. 11
Один из способов снизить стоимость LIB — ускорить процесс смачивания. 12 Weydanz et al. 13 показали, что розлив под вакуумом до 100 мбар значительно ускоряет этот производственный этап. Habedank et al. 14 даже достиг в 12 раз более быстрого смачивания за счет лазерного структурирования электродов, что дополнительно улучшает поведение C-rate. 15 Состояние смачивания определяется как смоченные и насыщенные поверхности и полости электродов и сепаратора по сравнению с полными поверхностями и полостями узла ячейки. Заполнение полостей, которые представляют собой внутренние поверхности среды, можно описать как микроскопическое смачивание. А смачивание (макроскопических) поверхностей можно рассматривать как поверхностное смачивание. Первые можно измерить с помощью спектроскопии электрохимического импеданса (EIS). 16,17 Последнее можно визуализировать с помощью нейтронной радиографии. 18 Еще один способ снизить затраты на киловатт-час — это снизить материальные затраты, например, за счет минимизации количества электролита на элемент. 12 В лабораторных условиях дозируется непропорционально большое количество электролита по сравнению с поверхностями компонентов в однослойных ячейках. Напротив, при производстве промышленных ячеек в ячейках большого формата не хватает пустого пространства для содержания электролита в таком же соотношении к поверхности активного материала и сепаратора. 19 Кроме того, поскольку электролит является неактивным материалом, слишком много и, следовательно, ненужного электролита является мертвым грузом, что снижает плотность энергии и увеличивает стоимость батареи. 10
16,17 Последнее можно визуализировать с помощью нейтронной радиографии. 18 Еще один способ снизить затраты на киловатт-час — это снизить материальные затраты, например, за счет минимизации количества электролита на элемент. 12 В лабораторных условиях дозируется непропорционально большое количество электролита по сравнению с поверхностями компонентов в однослойных ячейках. Напротив, при производстве промышленных ячеек в ячейках большого формата не хватает пустого пространства для содержания электролита в таком же соотношении к поверхности активного материала и сепаратора. 19 Кроме того, поскольку электролит является неактивным материалом, слишком много и, следовательно, ненужного электролита является мертвым грузом, что снижает плотность энергии и увеличивает стоимость батареи. 10
Чтобы точно определить влияние количества производимого электролита, были построены большие элементы, заполненные различным количеством электролита. Эти ячейки были измерены во время смачивания с помощью импедансной спектроскопии, затем подверглись процедуре формирования и были циклически проверены на срок службы.
Эти ячейки были измерены во время смачивания с помощью импедансной спектроскопии, затем подверглись процедуре формирования и были циклически проверены на срок службы.
Cell-Assembly
Ячейки-пакеты, состоящие из 13 анодных листов и 12 катодных листов, были собраны в Техническом университете Мюнхена на полуавтоматических машинах в сухом помещении с точкой росы ниже — 55 ° C. Катодные листы состояли из двустороннего покрытия LiNi 1/3 Co 1/3 Mn 1/3 O 2 (NCM111) на алюминиевой фольге коллектора, а для анода в качестве активного материала использовался графит. покрытие с обеих сторон медного коллектора.Точные характеристики имеющихся в продаже электродов с покрытием показаны в таблице I. Электродные листы были разделены в процессе удаленной лазерной резки, как описано в ссылке. 20 в формат 101 мм × 73 мм (катод) и 104 мм × 76 мм (анод). Коммерческий сепаратор (Celgard 2325) был зажат между электродами в z-образной форме, чтобы обеспечить электрическую изоляцию, и обернут вокруг пакета ячеек для обеспечения механической устойчивости, удерживая электроды в их точном положении. Язычки и фольга токосъемника были соединены с помощью ультразвуковой сварки, а готовый пакет ячеек был упакован в гибкий пакет с углубленным карманом.С трех сторон пакет из фольги запечатывали импульсными запаивающими планками, оставляя одну сторону открытой для заполнения электролитом. Для предотвращения нежелательных побочных реакций с остаточной влажностью, как указано в Ref. 21, они были высушены в вакуумной печи при 60 ° C и 20 мбар перед последующим заполнением в течение ночи. Подробности процедуры заполнения будут объяснены в следующем разделе. До и после каждого этапа производства ячейки взвешивались, чтобы отобразить влияние каждого этапа процесса на плотность энергии продукта посредством сборки ячеек, как показано на рисунке 1.
Язычки и фольга токосъемника были соединены с помощью ультразвуковой сварки, а готовый пакет ячеек был упакован в гибкий пакет с углубленным карманом.С трех сторон пакет из фольги запечатывали импульсными запаивающими планками, оставляя одну сторону открытой для заполнения электролитом. Для предотвращения нежелательных побочных реакций с остаточной влажностью, как указано в Ref. 21, они были высушены в вакуумной печи при 60 ° C и 20 мбар перед последующим заполнением в течение ночи. Подробности процедуры заполнения будут объяснены в следующем разделе. До и после каждого этапа производства ячейки взвешивались, чтобы отобразить влияние каждого этапа процесса на плотность энергии продукта посредством сборки ячеек, как показано на рисунке 1.
Таблица I. Технические характеристики используемых электродов.
Приблизить Уменьшить Сбросить размер изображения
Рисунок 1. Изменение доли NMC на этапах процесса сборки электролизера после изготовления электродов в качестве индикатора влияния сборки электролизера на удельную энергию продукта. Объемный коэффициент vf описывает количество дозированного электролита и приведен в таблице II.
Изменение доли NMC на этапах процесса сборки электролизера после изготовления электродов в качестве индикатора влияния сборки электролизера на удельную энергию продукта. Объемный коэффициент vf описывает количество дозированного электролита и приведен в таблице II.
Filling-Process
1 M раствор LiPF 6 в смеси этиленкарбоната (EC) и этилметилкарбоната (EMC; массовое соотношение EC: EMC 3: 7) с 2 мас.% Виниленкарбоната (VC ) от BASF служил электролитом.Как правило, для крупноформатных ячеек требуется несколько итераций дозирования после поглощения жидкости узлом ячеек из-за небольшого количества пустого пространства в ячейке и высокого сопротивления потоку пористых структур. 22 Для данной экспериментальной схемы, из-за небольшого количества электролита по сравнению с объемом пустот между гибкой фольгой пакета и стопкой, одной стадии дозирования было достаточно. В результате заполнение состояло из шести этапов: промывка инертным газом, вакуумирование, дозирование, герметизация, удаление воздуха и смачивание. Электролит дозировали в вакуумной камере при абсолютном давлении 80 мбар. Количество варьировалось объемным фактором.
Электролит дозировали в вакуумной камере при абсолютном давлении 80 мбар. Количество варьировалось объемным фактором.
от 0,6 до 1,8 от объема пор компонентов ячейки (сепаратора и электродов). Средний объем пор ячеек составил 8,85 мл. Точность дозирования и полученные объемы электролита приведены в таблице II. Давление закрытия герметизирующих стержней было установлено на 3 бара в течение 3 секунд при температуре герметизации 195 ° C.
Таблица II. Точность дозирования, итоговое количество дозированного электролита и емкость ячеек после формирования, которые соответствуют токам при испытании на срок службы.
| объемный коэффициент | – | 0,6 | 0,8 | 1,0 | 1,2 | 1,4 | 1,6 | 1,8 |
| количество электролита | мл | 5. 35 35 | 7,11 | 8,77 | 10,98 | 12,54 | 14,26 | 15,82 |
| стандартное отклонение | мл | 0,08 | 0,04 | 0,17 | 0,04 | 0,13 | 0,16 | 0,19 |
| количество электролита | мл Ач — 1 теор | 1,10 | 1,46 | 1,81 | 2.26 | 2,58 | 2,93 | 3,26 |
| емкость ячейки | Ач рев. | 2,68 | 3,23 | 3,33 | 3,16 | 3,28 | 3,41 | 3,44 |
| стандартное отклонение | Ач рев. | 0,12 | 0,07 | 0,04 | 0,07 | 0,11 | 0,01 | 0.02 |
| количество ячеек | – | 3 | 5 | 6 | 3 | 4 | 3 | 4 |
После вентиляции камеры ячейки выдерживались под атмосферным давлением в течение 180 минут перед первой загрузкой. Во время этого смачивания электрохимические измерения проводились с помощью потенциостата Interface 5000E от Gamry Instruments. Последовательность состояла из измерений потенциала разомкнутого тока (OCV) и EIS и была запрограммирована на повторение в течение как минимум 90 минут.Сначала измеряли OCV в течение 15 секунд с периодом выборки 0,5 секунды. Впоследствии потенциостатический EIS был запущен с начальной частотой 100 кГц и был изменен на 1 Гц с 10 точками на декаду и амплитудой 10 rms мВ в качестве сигнала возбуждения переменного тока, подаваемого на ячейку. Постоянное потенциальное смещение, которое может применяться к ячейке на протяжении всего сбора данных, было установлено равным нулю по сравнению с OCV ячейки. Напряжение переменного тока суммировалось с напряжением постоянного тока.
Во время этого смачивания электрохимические измерения проводились с помощью потенциостата Interface 5000E от Gamry Instruments. Последовательность состояла из измерений потенциала разомкнутого тока (OCV) и EIS и была запрограммирована на повторение в течение как минимум 90 минут.Сначала измеряли OCV в течение 15 секунд с периодом выборки 0,5 секунды. Впоследствии потенциостатический EIS был запущен с начальной частотой 100 кГц и был изменен на 1 Гц с 10 точками на декаду и амплитудой 10 rms мВ в качестве сигнала возбуждения переменного тока, подаваемого на ячейку. Постоянное потенциальное смещение, которое может применяться к ячейке на протяжении всего сбора данных, было установлено равным нулю по сравнению с OCV ячейки. Напряжение переменного тока суммировалось с напряжением постоянного тока.
Кривые EIS были проанализированы с акцентом на высокочастотное сопротивление (HFR).HFR ячейки — это значение импеданса, при котором мнимая часть равна нулю. Он интерпретируется как внутреннее сопротивление элемента и изменяется во время смачивания компонентов элемента жидким электролитом. 17
17
Процесс формирования и испытание на срок службы
Формирование проводили с использованием испытательной системы ячеек BaSyTec, подключенной к ячейкам в температурной камере при 25 ° C. Процесс состоял из 2 циклов при скорости C 0,1 ° C (что соответствует 4,86 Ач те или ).Ячейки заряжались в режиме постоянного тока и постоянного напряжения (CCCV) с ограничением тока, соответствующим C / 20, в то время как разряд выполнялся в режиме постоянного тока (CC). Верхнее напряжение отсечки было установлено на 4,2 В, а нижнее напряжение отсечки было установлено на 2,5 В.
Перед началом испытания на срок службы элементы были дегазированы, удаляя газ, который образовался во время первых циклов зарядки и разрядки в результате химических реакций между ними. электроды и электролит, а также активация электродов.Сначала клетки были измерены с помощью EIS, используя ту же процедуру, что и в последнем разделе. Из-за временной стабильности EIS только трех циклов измерения было достаточно, чтобы зафиксировать поведение импеданса ячейки после цикла.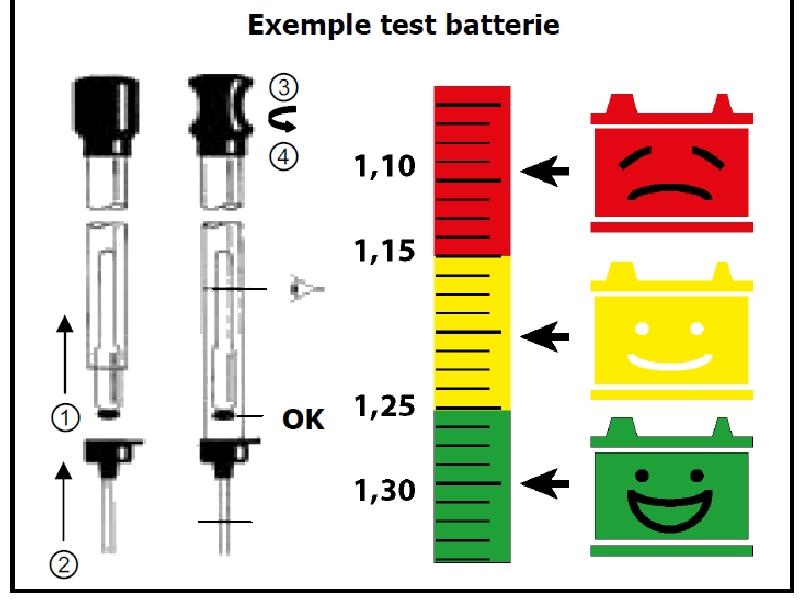 Затем клетки помещали в вакуумную камеру. Камера промывалась инертным газом и откачивалась до 100 мбар, что было немного выше, чем уровень давления для дозирования электролита в последней секции. Ячейки открыли для удаления газа и снова запечатали. После вентиляции камеры мешок с избыточным газом упаковки был вырезан, и клетки снова были измерены с помощью EIS и взвешены.
Затем клетки помещали в вакуумную камеру. Камера промывалась инертным газом и откачивалась до 100 мбар, что было немного выше, чем уровень давления для дозирования электролита в последней секции. Ячейки открыли для удаления газа и снова запечатали. После вентиляции камеры мешок с избыточным газом упаковки был вырезан, и клетки снова были измерены с помощью EIS и взвешены.
Обратимые емкости клеток определяли по второму циклу формирования. Вернувшись в температурную камеру, циклирование выполнялось при 1 C (Ah rev ) и 25 ° C в режиме CCCV для зарядки с ограничением тока, соответствующем C / 20, и в режиме CC для разряда. Перед каждой серией из 50 циклов при 1 ° C выполняли один цикл при 0,1 ° C, а затем один цикл при 0,5 ° C. После завершения испытания на срок службы клетки измеряли с помощью EIS в четвертый раз.
Для каждого варианта были протестированы не менее трех независимых ячеек, и данные на рисунках всегда представляют собой среднее значение этих ячеек. Планки погрешностей на рисунках представляют собой стандартное отклонение измерений.
Планки погрешностей на рисунках представляют собой стандартное отклонение измерений.
На рис. 1 показана массовая доля NMC в общей массе промежуточного продукта, полученного посредством процессов сборки ячеек. Поскольку (без электролита) активный материал катода является единственным резервуаром лития в элементе, содержание NMC является показателем плотности энергии элемента.Начальная доля катода в 76% уменьшается за счет таких этапов сборки, как z-складывание, которое добавляет сепаратор и аноды. Затем удельный вес дополнительно увеличивается за счет приваренных ультразвуком язычков и алюминиевой фольги упаковки. График разделен на различные количества электролита для участка, представляющего процесс заполнения. При увеличении количества электролита весовая доля NMC еще больше уменьшается. От vf 0,6 до 1,8 наблюдается разница почти в 10% в доле NMC.Окончательное увеличение доли NMC связано с удалением фольги мешка для отходов после дегазации.
Измерения EIS после дозирования электролита показаны на рисунке 2a для смачивания ячеек.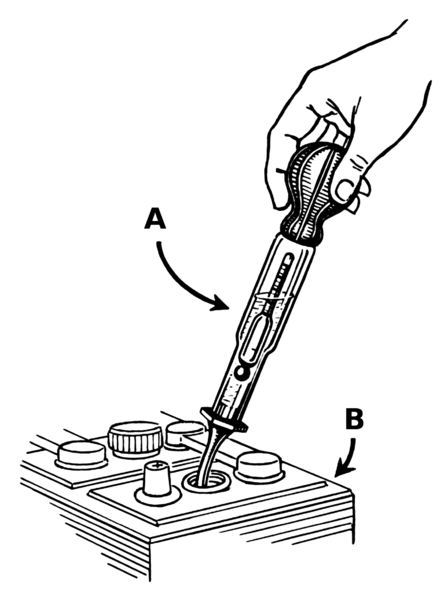 Результирующая HFR изменяется с течением времени и сходится к окончательному значению, как описано в Ref. 17. Эта точка схождения зависит от количества жидкого электролита. Большие дозированные количества приводят к более низким значениям HFR клеток после смачивания. Кроме того, HFR уменьшается и сходится для величин, больших или равных vf 1, тогда как он снова увеличивается для меньших величин перед сходимостью.Относительно скорости смачивания
Результирующая HFR изменяется с течением времени и сходится к окончательному значению, как описано в Ref. 17. Эта точка схождения зависит от количества жидкого электролита. Большие дозированные количества приводят к более низким значениям HFR клеток после смачивания. Кроме того, HFR уменьшается и сходится для величин, больших или равных vf 1, тогда как он снова увеличивается для меньших величин перед сходимостью.Относительно скорости смачивания
(со степенью смачивания) влияние на скорость смачивания также становится заметным на рисунке 2b. Скорость смачивания клеток с vf 0,6 и 0,8 пересекает нулевую линию в отрицательный диапазон и медленно снова приближается к нулю. В отличие от ячеек с большим количеством электролита, эти ячейки еще не завершили смачивание за время измерения 150 мин. Увеличение HFR и связанное с этим более длительное смачивание ячеек является результатом недостаточного количества электролита в ячейке.На этом этапе можно различить две фазы микроскопического смачивания.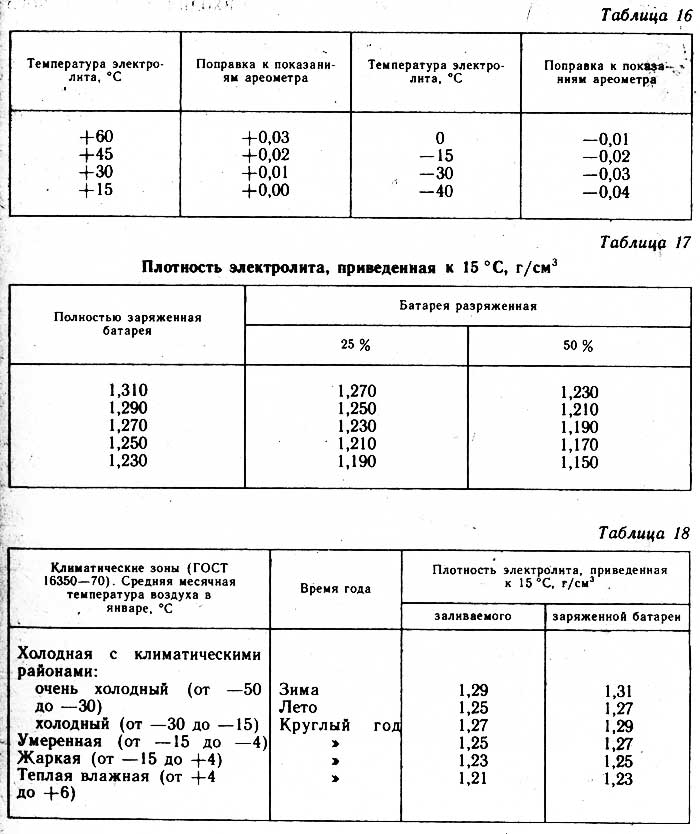 Во время первой фазы смачивания HFR элементов уменьшается, как и в элементах с большим количеством электролита. Причина этого может заключаться в том, что электролит сначала проникает через участки поверхности компонентов ячейки, которые находятся в прямом контакте с жидкостью, и начинает сжимать или замещать остаточный газ в порах. Эта фаза смачивания заканчивается минимальной HFR (рис. 2а) или переходом через ноль скорости смачивания (рис. 2b).Минимум получается из-за локального избытка электролита, который замыкает электрическую цепь параллельно несмачиваемым участкам во время измерения EIS. На втором этапе жидкость электролита перераспределяется в оставшиеся поры, которые еще не заполнены электролитом в такой же степени. Капиллярные силы, действующие во время проникновения, зависят от радиуса пор. 23 Следовательно, объемная доля жидкого электролита в малых порах увеличивается за счет более крупных пор с тем же углом смачивания, если присутствует недостаточно электролита.
Во время первой фазы смачивания HFR элементов уменьшается, как и в элементах с большим количеством электролита. Причина этого может заключаться в том, что электролит сначала проникает через участки поверхности компонентов ячейки, которые находятся в прямом контакте с жидкостью, и начинает сжимать или замещать остаточный газ в порах. Эта фаза смачивания заканчивается минимальной HFR (рис. 2а) или переходом через ноль скорости смачивания (рис. 2b).Минимум получается из-за локального избытка электролита, который замыкает электрическую цепь параллельно несмачиваемым участкам во время измерения EIS. На втором этапе жидкость электролита перераспределяется в оставшиеся поры, которые еще не заполнены электролитом в такой же степени. Капиллярные силы, действующие во время проникновения, зависят от радиуса пор. 23 Следовательно, объемная доля жидкого электролита в малых порах увеличивается за счет более крупных пор с тем же углом смачивания, если присутствует недостаточно электролита. Вторая фаза завершается, когда достигается равновесие сил (например, капиллярных сил, сжатия газа, силы тяжести и т. Д.) Между порами всех компонентов ячейки. Макроскопически теперь наблюдается однородное распределение жидкого электролита. HFR остается постоянным во времени, а скорость смачивания приближается к нулю.
Вторая фаза завершается, когда достигается равновесие сил (например, капиллярных сил, сжатия газа, силы тяжести и т. Д.) Между порами всех компонентов ячейки. Макроскопически теперь наблюдается однородное распределение жидкого электролита. HFR остается постоянным во времени, а скорость смачивания приближается к нулю.
Приблизить Уменьшить Сбросить размер изображения
Рисунок 2. а) HFR ячеек при смачивании жидким электролитом; б) Скорость смачивания как функция времени после дозирования жидкого электролита.
Помимо недонасыщения электролитической жидкости, подробное картирование скорости смачивания показывает, что зависимость от количества электролита незначительна (для исследованных количеств и формата ячейки). Влияние гидростатического давления столба жидкости на пакет ячеек приводит к разнице в 0,06 мОм в первые 10 минут и снижается до менее 0,01 мОм через 20 минут. Можно предположить, что гидростатическое давление не оказывает большого влияния, поскольку даже максимальный дозируемый объем составляет 16.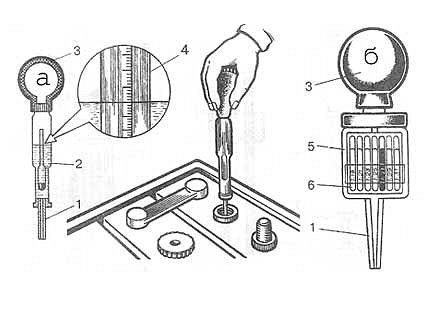 01 мл остается небольшим по сравнению с смачиваемыми поверхностями.
01 мл остается небольшим по сравнению с смачиваемыми поверхностями.
Влияние количества электролита на обратимую емкость и плотность энергии ячеек после образования показано на Рисунке 3 как функция от коэффициента C. Объемный коэффициент 1 соответствует отмеренному количеству электролита, равному величине всех полостей электродов и сепаратора. Однако никакие границы раздела или объемы между сепаратором и электродами не принимаются во внимание. Следовательно, для достижения максимально возможной производительности за счет смачивания всех пустотных объемов необходим коэффициент, превышающий vf 1.Емкость при 0,1 ° C увеличивается с vf 0,6 до 1,2, а затем остается постоянной, поскольку vf продолжает увеличиваться. При 0,5 и 1 ° C он не меняется до vf 1,4. Превосходное электрическое поведение ячеек с vf 1 или меньшим, чем 1 C, можно объяснить диффузией носителей заряда: во время этих более длительных фаз заряда / разряда носители заряда имеют достаточно времени для обхода недостаточно ) смоченные участки ячеек. Максимальная плотность энергии достигается при 0,1 C и vf 0,8. Чем больше электролита дозируется в ячейки, тем ниже становится плотность энергии после этого пика.Причина такого поведения — уменьшение веса активного материала, которое оказывает большее влияние, чем увеличение емкости. Также можно показать, что плотность энергии при 1 C не уменьшается так быстро, как при более низких скоростях C.
Максимальная плотность энергии достигается при 0,1 C и vf 0,8. Чем больше электролита дозируется в ячейки, тем ниже становится плотность энергии после этого пика.Причина такого поведения — уменьшение веса активного материала, которое оказывает большее влияние, чем увеличение емкости. Также можно показать, что плотность энергии при 1 C не уменьшается так быстро, как при более низких скоростях C.
Приблизить Уменьшить Сбросить размер изображения
Рисунок 3. Обратимая удельная емкость (столбцы слева) и удельная энергия (столбцы справа) ячеек в зависимости от количества электролита в течение первых трех циклов (0.1 C, 0,5 C, 1 C) испытания на срок службы.
На рисунке 4 показана удельная емкость ячеек во время испытания на срок службы в зависимости от объемного фактора, а также от коэффициента C. Емкость тем выше, чем ниже C-rate, и уменьшается с увеличением количества циклов. Поскольку после 50 циклов клетки циклируются с двумя более низкими скоростями C, на графике появляются небольшие скачки при 1 C, что соответствует восстановлению клеток после низких скоростей. Ячейки с vf 0,6 уже испытывают резкое падение емкости в течение первых 50 циклов и теряют свою функциональность из-за недостаточного количества электролита внутри элементов.Ян и др. 24 различают линейное и нелинейное старение. В то время как рост SEI за счет электролита играет доминирующую роль в линейной фазе, нелинейное старение является индикатором литиевого покрытия, вызванного большими локальными градиентами электролита в аноде и на границе раздела с сепаратором. 24 Здесь после формирования кулоновская эффективность ячеек с vf 0,6 [vf 1] составляет 99% (± 1) [102,5% (± 1,1)] при 0,1 C. При 1 ° C она быстро падает до 78% ( ± 2) [95.8% (± 0,5)], а затем требуется около 30 циклов [1 цикл] для достижения эффективности 97% (± 1) [99,9% (± 0)]. Предполагается, что емкость, которую не удалось восстановить во время разряда, на которую указывает эффективность, будет размещена в позднем здании ГЭИ. В дополнение к восстановлению SEI из-за растрескивания во время работы, 9 дополнительный SEI образуется несмаченными участками, вытягивающими электролит из уже увлажненных участков из-за изменения преобладающего равновесия сил.
Ячейки с vf 0,6 уже испытывают резкое падение емкости в течение первых 50 циклов и теряют свою функциональность из-за недостаточного количества электролита внутри элементов.Ян и др. 24 различают линейное и нелинейное старение. В то время как рост SEI за счет электролита играет доминирующую роль в линейной фазе, нелинейное старение является индикатором литиевого покрытия, вызванного большими локальными градиентами электролита в аноде и на границе раздела с сепаратором. 24 Здесь после формирования кулоновская эффективность ячеек с vf 0,6 [vf 1] составляет 99% (± 1) [102,5% (± 1,1)] при 0,1 C. При 1 ° C она быстро падает до 78% ( ± 2) [95.8% (± 0,5)], а затем требуется около 30 циклов [1 цикл] для достижения эффективности 97% (± 1) [99,9% (± 0)]. Предполагается, что емкость, которую не удалось восстановить во время разряда, на которую указывает эффективность, будет размещена в позднем здании ГЭИ. В дополнение к восстановлению SEI из-за растрескивания во время работы, 9 дополнительный SEI образуется несмаченными участками, вытягивающими электролит из уже увлажненных участков из-за изменения преобладающего равновесия сил. Низкая максимальная эффективность 97% при 1 ° C для vf 0.6 является результатом местных плохо или даже не увлажненных участков, которые имеют более высокое сопротивление и, следовательно, способствуют нанесению литиевого покрытия по сравнению с другими участками. 25 При дальнейшем истощении электролита ионная проводимость через поры сепаратора уменьшается, прекращая функциональность ячеек. По этой причине предполагается, что истощение электролита и последующее литиевое покрытие является механизмом разрушения элементов.
Низкая максимальная эффективность 97% при 1 ° C для vf 0.6 является результатом местных плохо или даже не увлажненных участков, которые имеют более высокое сопротивление и, следовательно, способствуют нанесению литиевого покрытия по сравнению с другими участками. 25 При дальнейшем истощении электролита ионная проводимость через поры сепаратора уменьшается, прекращая функциональность ячеек. По этой причине предполагается, что истощение электролита и последующее литиевое покрытие является механизмом разрушения элементов.
Приблизить Уменьшить Сбросить размер изображения
Рисунок 4. Характеристики ячеек в течение всего срока службы после формирования. Тест состоял из 20 [0,1 C, 0,5 C, 50 [1 C]] циклов в режиме CCCV для зарядки и в режиме CC для разряда.
По мере увеличения количества электролита до vf 1,4 характеристики ячеек улучшаются, так что потери емкости в течение их срока службы уменьшаются. Однако для больших количеств (vf 1,6–1,8) большая потеря емкости может наблюдаться в увеличенном виде первых 200 циклов при 1 ° C на Рисунке 4. Ячейки могут до некоторой степени компенсировать эту потерю: даже несмотря на то, что емкость при 0,5 C после 650 циклов снова выше, чем для vf 1,2, элементы остаются ниже производительности этих элементов с vf 1,4 даже при более высоких циклах. Этот нежелательный эффект потери емкости во время первых циклов можно объяснить избытком VC. Добавка, не израсходованная во время формирования, создает показатель CEI во время цикла до тех пор, пока не будет исчерпан. Таким образом, он связывает литий, который впоследствии больше не может участвовать в перезарядке. 26
Ячейки могут до некоторой степени компенсировать эту потерю: даже несмотря на то, что емкость при 0,5 C после 650 циклов снова выше, чем для vf 1,2, элементы остаются ниже производительности этих элементов с vf 1,4 даже при более высоких циклах. Этот нежелательный эффект потери емкости во время первых циклов можно объяснить избытком VC. Добавка, не израсходованная во время формирования, создает показатель CEI во время цикла до тех пор, пока не будет исчерпан. Таким образом, он связывает литий, который впоследствии больше не может участвовать в перезарядке. 26
Два различных эффекта, потеря лития и истощение электролита, также можно наблюдать на рисунке 5, представляющем напряжение разряда в зависимости от емкости элементов. Во время первого цикла преобладает недостаток электролита. Чем больше электролита присутствует в элементах, тем выше напряжение во время разряда и тем выше емкость, при которой напряжение падает до напряжения отсечки. Это эквивалентно уменьшению перенапряжения с увеличением количества электролита и, таким образом, увеличению разрядной емкости элемента.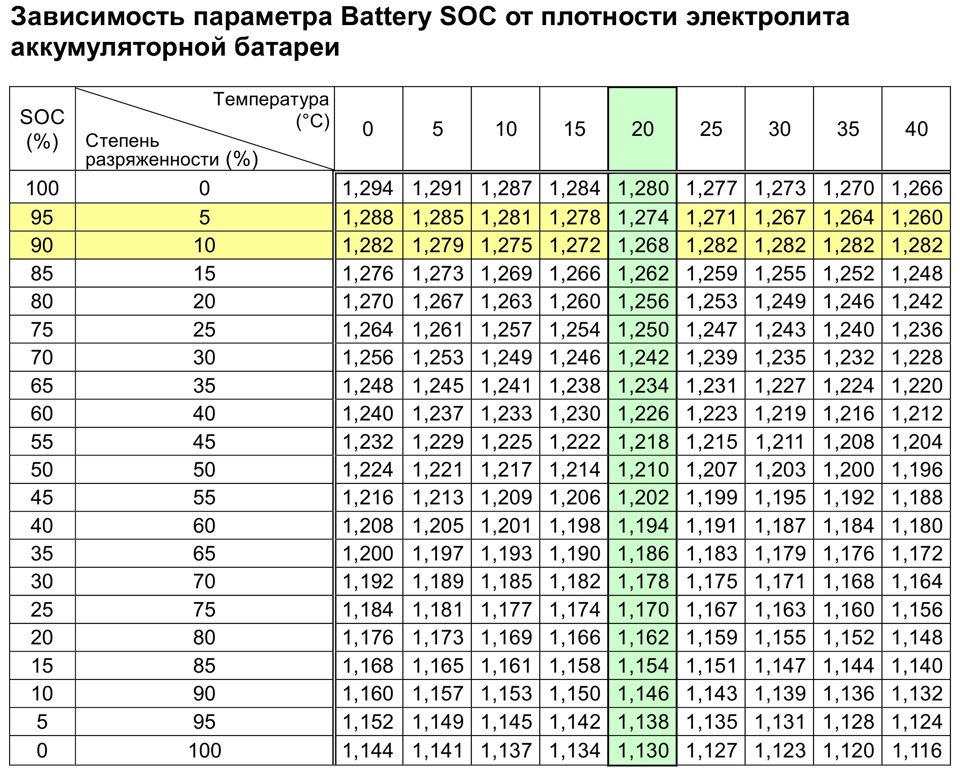 После 100 циклов ячейка с vf 0,6 уже разрушилась. Поскольку применялись высокие скорости зарядки при относительно низких температурах, возможными причинами могут быть нанесение литиевого покрытия уже в первых циклах 27 или недоступные электродные области. Ячейки с vf 1,6 и vf 1,8 остаются при более высоких напряжениях примерно до 2,5 Ач, но затем падают, так что емкость элементов соответствует емкости ячеек с vf 0,8. Эта потеря емкости связана с недоступным количеством лития, который лигирован в CEI.Ячейки с vf 1,2 и 1,4 по-прежнему генерируют высокое напряжение во всем диапазоне емкости, а также высокую конечную емкость. Однако после 500 циклов эти элементы (vf 1.2 и 1.4) страдают от потери напряжения в начале фазы разряда, что, как предполагается, является результатом литиевого покрытия в сочетании с повышенным SEI. Хотя ячейки, заполненные vf 1.4, все еще достигают максимальной емкости, напряжение vf 1.6 и 1.8 выше при одновременной более низкой емкости. Как правило, напряжение в начале процесса разряда падает из-за того, что в элементах присутствует меньше электролита.
После 100 циклов ячейка с vf 0,6 уже разрушилась. Поскольку применялись высокие скорости зарядки при относительно низких температурах, возможными причинами могут быть нанесение литиевого покрытия уже в первых циклах 27 или недоступные электродные области. Ячейки с vf 1,6 и vf 1,8 остаются при более высоких напряжениях примерно до 2,5 Ач, но затем падают, так что емкость элементов соответствует емкости ячеек с vf 0,8. Эта потеря емкости связана с недоступным количеством лития, который лигирован в CEI.Ячейки с vf 1,2 и 1,4 по-прежнему генерируют высокое напряжение во всем диапазоне емкости, а также высокую конечную емкость. Однако после 500 циклов эти элементы (vf 1.2 и 1.4) страдают от потери напряжения в начале фазы разряда, что, как предполагается, является результатом литиевого покрытия в сочетании с повышенным SEI. Хотя ячейки, заполненные vf 1.4, все еще достигают максимальной емкости, напряжение vf 1.6 и 1.8 выше при одновременной более низкой емкости. Как правило, напряжение в начале процесса разряда падает из-за того, что в элементах присутствует меньше электролита. Однако потеря лития в элементах (из-за чрезмерного наращивания CEI) указывается преждевременным падением напряжения с высокого уровня по сравнению с элементами без чрезмерного CEI.
Однако потеря лития в элементах (из-за чрезмерного наращивания CEI) указывается преждевременным падением напряжения с высокого уровня по сравнению с элементами без чрезмерного CEI.
Приблизить Уменьшить Сбросить размер изображения
Рис. 5. Напряжение разряда над емкостью характеристической ячейки как функция количества электролита для 1 st , 100 th и 500 th цикл при 1 C теста на срок службы.
CV-доля определяется как емкость, заряженная в режиме CV, по отношению к общей заряженной емкости Q в режимах CC и CV:
и показан на рисунке 6. Процент заряда может служить индикатором способности аккумуляторов к быстрой зарядке и зависит от скорости C: с увеличением SOC потенциал катода увеличивается, а потенциал графита приближается. 0 В по сравнению с Li + / Li . Разница между двумя потенциалами определяет напряжение ячейки.Таким образом, в режиме CC напряжение зарядки повышается, чтобы обеспечить заданный ток. Анод должен интеркалировать атомы лития за заданное время (определяемое скоростью C). Если скорость интеркаляции на аноде ниже, чем скорость переноса Li + в электролите, вызванная током заряда, литий накапливается на поверхности анода. Потенциал графита падает ниже 0 В по сравнению с Li + / Li , и металлическое покрытие литием происходит на верхней части анода.Следовательно, высокие концентрации углерода способствуют нанесению литиевого покрытия. 28 Кроме того, гальваническое покрытие может быть вызвано несмачиваемыми участками анода или сепаратора из-за результирующего неоднородного распределения плотности тока. 29 Отрицательный потенциал анода (по сравнению с литием) приводит к тому, что напряжение ячейки превышает потенциал катода, так что верхнее напряжение отсечки и, следовательно, фаза CV достигается раньше. 30 На верхнем уровне напряжения отсечки, напряжение поддерживается постоянным в режиме CV, и элемент будет заряжаться, пока ток не упадет до состояния отсечки.
Анод должен интеркалировать атомы лития за заданное время (определяемое скоростью C). Если скорость интеркаляции на аноде ниже, чем скорость переноса Li + в электролите, вызванная током заряда, литий накапливается на поверхности анода. Потенциал графита падает ниже 0 В по сравнению с Li + / Li , и металлическое покрытие литием происходит на верхней части анода.Следовательно, высокие концентрации углерода способствуют нанесению литиевого покрытия. 28 Кроме того, гальваническое покрытие может быть вызвано несмачиваемыми участками анода или сепаратора из-за результирующего неоднородного распределения плотности тока. 29 Отрицательный потенциал анода (по сравнению с литием) приводит к тому, что напряжение ячейки превышает потенциал катода, так что верхнее напряжение отсечки и, следовательно, фаза CV достигается раньше. 30 На верхнем уровне напряжения отсечки, напряжение поддерживается постоянным в режиме CV, и элемент будет заряжаться, пока ток не упадет до состояния отсечки.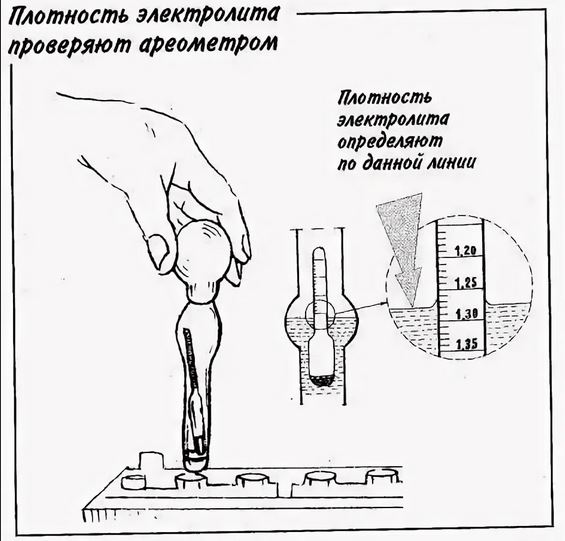 Таким образом, небольшая доля CV является синонимом высокой скорости интеркаляции анода и полностью смоченного сепаратора, как показано на рисунке 6: чем больше электролита дозируется в ячейки, тем ниже доля CV. С увеличением количества циклов и C-rate доля CV увеличивается. Следовательно, элементы не только должны заряжаться в течение более длительного времени, но они также должны подвергаться более длительному воздействию более высоких напряжений, что представляет собой нагрузку на компоненты элемента. 31
Таким образом, небольшая доля CV является синонимом высокой скорости интеркаляции анода и полностью смоченного сепаратора, как показано на рисунке 6: чем больше электролита дозируется в ячейки, тем ниже доля CV. С увеличением количества циклов и C-rate доля CV увеличивается. Следовательно, элементы не только должны заряжаться в течение более длительного времени, но они также должны подвергаться более длительному воздействию более высоких напряжений, что представляет собой нагрузку на компоненты элемента. 31
Приблизить Уменьшить Сбросить размер изображения
Рисунок 6. CV-доля клеток в течение жизненного цикла после образования. CV-доля определяется как емкость, заряженная в режиме CV, по отношению к общей заряженной емкости в режимах CC и CV. Испытание на срок службы состояло из 20 [0,1 C, 0,5 C, 50 [1 C]] циклов в режиме CCCV для зарядки и в режиме CC для разряда.
HFR всех ячеек после смачивания, формирования, дегазации и испытания срока службы показаны на рисунке 7. Предполагалось, что SOC всех ячеек равняется 0%, поскольку они либо никогда не заряжались (просто смачивались), либо разряжались до напряжения 2.5 В. HFR после дегазации немного выше, чем после образования. Причиной этого может быть то, что небольшое количество жидкого электролита вытягивается из пор во время дегазации и должно повторно занимать это пространство. Для ячеек с vf от 0,6 до 1,2 оба значения HFR после образования и дегазации выше, чем HFR после смачивания. От vf 1,4 до 1,8 HFR после образования и после дегазации ниже, чем после смачивания. В сочетании с электрохимическими характеристиками во время испытания на срок службы измерения показывают, что количество электролита не менее vf 1.4 требуется, чтобы позволить SEI полностью сформироваться во время формирования и обеспечить оптимальную ионную проводимость через сепаратор, необходимую для перезарядки. Передача заряда между электролитом и анодом даже улучшается за счет образования SEI с достаточным количеством электролита, как показывают значения HFR.
Предполагалось, что SOC всех ячеек равняется 0%, поскольку они либо никогда не заряжались (просто смачивались), либо разряжались до напряжения 2.5 В. HFR после дегазации немного выше, чем после образования. Причиной этого может быть то, что небольшое количество жидкого электролита вытягивается из пор во время дегазации и должно повторно занимать это пространство. Для ячеек с vf от 0,6 до 1,2 оба значения HFR после образования и дегазации выше, чем HFR после смачивания. От vf 1,4 до 1,8 HFR после образования и после дегазации ниже, чем после смачивания. В сочетании с электрохимическими характеристиками во время испытания на срок службы измерения показывают, что количество электролита не менее vf 1.4 требуется, чтобы позволить SEI полностью сформироваться во время формирования и обеспечить оптимальную ионную проводимость через сепаратор, необходимую для перезарядки. Передача заряда между электролитом и анодом даже улучшается за счет образования SEI с достаточным количеством электролита, как показывают значения HFR. Однако в течение срока службы внутреннее сопротивление элемента увеличивается из-за расхода электролита, нежелательных реакций и образования дополнительных SEI и CEI. Стандартное отклонение измерений не позволяет делать какие-либо существенные выводы, но существует тенденция к тому, что HFR увеличивается в меньшей степени в течение срока службы с большими количествами электролита, чем с элементами с небольшими количествами электролита.
Однако в течение срока службы внутреннее сопротивление элемента увеличивается из-за расхода электролита, нежелательных реакций и образования дополнительных SEI и CEI. Стандартное отклонение измерений не позволяет делать какие-либо существенные выводы, но существует тенденция к тому, что HFR увеличивается в меньшей степени в течение срока службы с большими количествами электролита, чем с элементами с небольшими количествами электролита.
Приблизить Уменьшить Сбросить размер изображения
Рис. 7. HFR ячеек после смачивания, формирования, дегазации и испытания на срок службы (1040 циклов без образования) для различных количеств электролита при SOC 0.
Исследование, на котором основана эта статья, показало, что плотность энергии, а также емкость литий-ионных батарей зависят от количества электролита. Слишком мало электролита приводит к потере емкости и срока службы, тогда как слишком большое количество электролита снижает плотность энергии.Для оптимального смачивания компонентов ячейки электролитом определялось минимальное количество электролита, соответствующее объему пор. Кроме того, избыток ВК сравнивали с недостатком электролита в течение срока службы элементов. Оба механизма отказа можно распознать по разному напряжению разряда в зависимости от емкости. При недостатке электролита напряжение резко падает уже в начале процесса разрядки, а превышение VC приводит к более позднему, но более сильному падению напряжения в конце фазы разрядки.Доля CV при циклировании увеличивается с уменьшением количества электролита и без влияния чрезмерных количеств VC. Следовательно, предполагается, что без чрезмерной добавки VC и с увеличением количества электролита характеристики повышаются в течение срока службы, особенно при более высоких скоростях C. Также было показано, что HFR уменьшается с увеличением количества электролита. При слишком низком количестве электролита можно использовать EIS для обнаружения перераспределения электролита в порах.Таким образом, EIS не может использоваться только для измерения распределения электролита после завершения смачивания компонентов ячейки, но также помогает выяснить, было ли дозировано достаточное количество электролита для данной структуры пор.
Кроме того, избыток ВК сравнивали с недостатком электролита в течение срока службы элементов. Оба механизма отказа можно распознать по разному напряжению разряда в зависимости от емкости. При недостатке электролита напряжение резко падает уже в начале процесса разрядки, а превышение VC приводит к более позднему, но более сильному падению напряжения в конце фазы разрядки.Доля CV при циклировании увеличивается с уменьшением количества электролита и без влияния чрезмерных количеств VC. Следовательно, предполагается, что без чрезмерной добавки VC и с увеличением количества электролита характеристики повышаются в течение срока службы, особенно при более высоких скоростях C. Также было показано, что HFR уменьшается с увеличением количества электролита. При слишком низком количестве электролита можно использовать EIS для обнаружения перераспределения электролита в порах.Таким образом, EIS не может использоваться только для измерения распределения электролита после завершения смачивания компонентов ячейки, но также помогает выяснить, было ли дозировано достаточное количество электролита для данной структуры пор.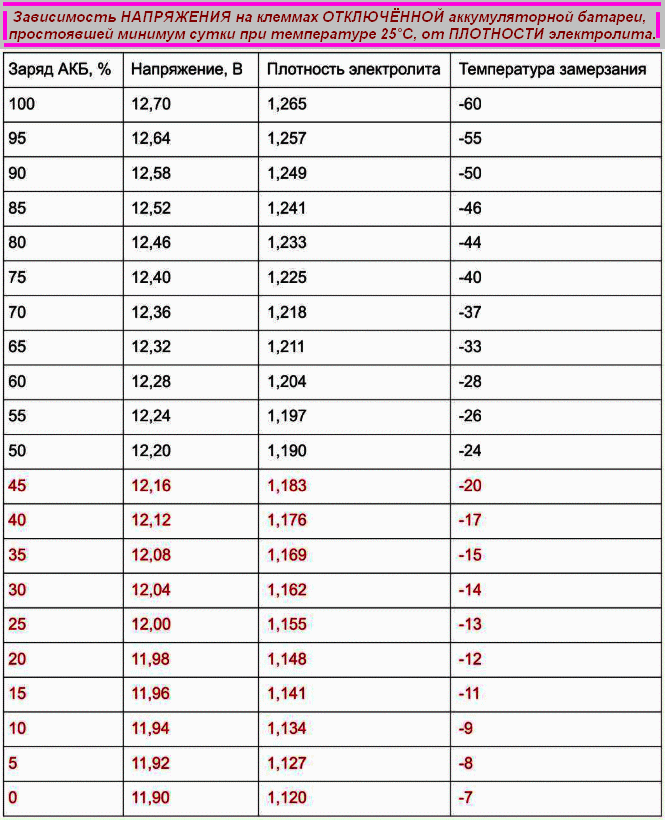 Этапы производства после заполнения и цикла влияют на внутреннее сопротивление ячейки в зависимости от дозированного объема электролита, который также можно измерить с помощью EIS и наблюдать с помощью HFR.
Этапы производства после заполнения и цикла влияют на внутреннее сопротивление ячейки в зависимости от дозированного объема электролита, который также можно измерить с помощью EIS и наблюдать с помощью HFR.
Становится ясной не только необходимость адаптации состава электролита к активным материалам и количества электролита на поверхность активного материала, но также необходимость адаптации количества электролита к желаемому заказчику применению.
Авторы выражают признательность Федеральному министерству образования и исследований Германии (BMBF) за финансирование их исследований в рамках проекта Cell-Fi (номер гранта 03XP0069C). Авторы благодарят Таню Цюнд за ее критический отзыв об электрохимической интерпретации, Яна Бернд Хабеданка и Ходу Мохсени за техническую поддержку в области лазерной резки и ультразвуковой сварки, а также Gamry Instruments за предоставление потенциостата.
Florian J. Günter 0000-0002-5967-6801
Последние достижения в области высоковольтных и высокоэнергетических водных аккумуляторных батарей
Водные аккумуляторные литиевые батареи (ARLB)
Водные аккумуляторные литиевые батареи (ARLB) были разрабатывается с 1994 г. [4].Они имеют среднее напряжение разряда около 1,5 В и работают обратимо. Они могут обеспечить удельную энергию 75 Вт · ч кг −1 (исходя из общей массы активных материалов), что сопоставимо с характеристиками свинцово-кислотных и никель-кадмиевых батарей. Как указано в этой новаторской исследовательской работе, окислительно-восстановительные потенциалы выделения водорода (HER) и кислорода (OER) являются важными контрольными факторами при выборе двух электродных материалов для ARLB. Иными словами, рабочий потенциал материала электрода должен быть между OER и HER, чтобы избежать реакции электролиза воды.В последнее время появилось много исчерпывающих обзоров электродных материалов ARLB [3, 5,6,7,8,9]. Поэтому мы не будем здесь подробно останавливаться на этом. В этой части мы только резюмируем текущую работу по ARLB высокого напряжения и плотности энергии.
[4].Они имеют среднее напряжение разряда около 1,5 В и работают обратимо. Они могут обеспечить удельную энергию 75 Вт · ч кг −1 (исходя из общей массы активных материалов), что сопоставимо с характеристиками свинцово-кислотных и никель-кадмиевых батарей. Как указано в этой новаторской исследовательской работе, окислительно-восстановительные потенциалы выделения водорода (HER) и кислорода (OER) являются важными контрольными факторами при выборе двух электродных материалов для ARLB. Иными словами, рабочий потенциал материала электрода должен быть между OER и HER, чтобы избежать реакции электролиза воды.В последнее время появилось много исчерпывающих обзоров электродных материалов ARLB [3, 5,6,7,8,9]. Поэтому мы не будем здесь подробно останавливаться на этом. В этой части мы только резюмируем текущую работу по ARLB высокого напряжения и плотности энергии.
Для создания ARLB высокого напряжения и высокой плотности энергии существует несколько стратегий: (1) улучшение электролита, например использование сверхконцентрированных электролитов, и (2) использование материалов отрицательных электродов (таких как сера, литий, цинк и др. ). графит) с высокой удельной емкостью и / или низким окислительно-восстановительным потенциалом [10].
). графит) с высокой удельной емкостью и / или низким окислительно-восстановительным потенциалом [10].
Сверхконцентрированные электролиты
Электролиты «вода в соли» / «вода в бисоле»
Электролит «вода в соли» (WiS) впервые был использован в ARLB в 2015 году Ван и его коллегами, что расширило окно электрохимической стабильности до прибл. 3,0 В (1,9–4,9 В относительно Li + / Li) и открыли новые возможности в водной электрохимии [11]. Бис (трифторметансульфонил) имид лития (LiTFSI) был выбран в качестве соли из-за его высокой растворимости в воде (> 20 м; в этой статье единица m относится к моль кг -1 ), а также из-за его высокой концентрации с гидратированная вода, обладающая высокой гидролитической стабильностью.Определение WiS применяется, когда вес и объем соли превышают вес и объем растворителя в бинарной системе. Когда концентрация LiTFSI достигает 21 м, его окно электрохимической стабильности увеличивается до 3 В (рис. 2а). В этом отчете LiMn 2 O 4 и Mo 6 S 8 были использованы в качестве материалов отрицательных электродов для сборки ARLB, что подтвердило возможность использования электролита WiS длиной 21 м. Стоит отметить, что окислительно-восстановительные потенциалы этих электродных материалов переходят в положительный потенциал с увеличением концентрации соли.Согласно уравнению Нернста, это в основном связано с изменением в нем активности Li + . Эти ARLB могут выдавать до 2,3 В и иметь среднее напряжение разряда 1,83 В, что значительно выше, чем у традиционных ARLB или ARLB 1-го поколения, использующих обычные водные растворы электролитов. Существует две причины, по которым электролит WiS имеет такой широкий диапазон напряжений (см. Рис. 2b). С одной стороны, свободных молекул воды достаточно, чтобы полностью гидратировать ионы лития в разбавленном водном растворе.С увеличением концентрации соли становится доступным меньше некоординированных молекул воды, и сольватация или гидратированный слой иона лития резко изменяется. Когда концентрация увеличивается до 21 мкм, отношение воды к иону лития составляет всего 2,6, что означает, что Li + частично обезвоживается, и электростатическое поле, создаваемое формальным зарядом на ионе лития, больше не может нейтрализоваться координацией с водой.
Стоит отметить, что окислительно-восстановительные потенциалы этих электродных материалов переходят в положительный потенциал с увеличением концентрации соли.Согласно уравнению Нернста, это в основном связано с изменением в нем активности Li + . Эти ARLB могут выдавать до 2,3 В и иметь среднее напряжение разряда 1,83 В, что значительно выше, чем у традиционных ARLB или ARLB 1-го поколения, использующих обычные водные растворы электролитов. Существует две причины, по которым электролит WiS имеет такой широкий диапазон напряжений (см. Рис. 2b). С одной стороны, свободных молекул воды достаточно, чтобы полностью гидратировать ионы лития в разбавленном водном растворе.С увеличением концентрации соли становится доступным меньше некоординированных молекул воды, и сольватация или гидратированный слой иона лития резко изменяется. Когда концентрация увеличивается до 21 мкм, отношение воды к иону лития составляет всего 2,6, что означает, что Li + частично обезвоживается, и электростатическое поле, создаваемое формальным зарядом на ионе лития, больше не может нейтрализоваться координацией с водой. В результате ионы TFSI — попадают в сольватационный слой Li + .Поскольку восстановительный потенциал TFSI — ниже, чем у воды, TFSI — разлагается на поверхности материала отрицательного электрода с образованием плотного защитного слоя SEI (в основном LiF) перед разложением воды. С другой стороны, активность воды снижается из-за небольшого количества свободных молекул воды после высокой концентрации, что помогает повысить электрохимическую стабильность положительных и отрицательных электродов. Таким образом, можно видеть, что взаимодействие этих двух факторов значительно расширяет диапазон напряжений электролита.Однако материалы положительного и отрицательного электрода, выбранные для батареи, не полностью используют окно напряжения электролита LiTFSI WiS. Аккумулятор Mo 6 S 8 / LiFePO 4 [12] и аккумулятор TiS 2 / LiMn 2 O 4 [13] ведут себя аналогично. Следовательно, необходима дальнейшая оптимизация материалов положительного и отрицательного электродов для дальнейшего повышения напряжения и плотности энергии ARLB.
В результате ионы TFSI — попадают в сольватационный слой Li + .Поскольку восстановительный потенциал TFSI — ниже, чем у воды, TFSI — разлагается на поверхности материала отрицательного электрода с образованием плотного защитного слоя SEI (в основном LiF) перед разложением воды. С другой стороны, активность воды снижается из-за небольшого количества свободных молекул воды после высокой концентрации, что помогает повысить электрохимическую стабильность положительных и отрицательных электродов. Таким образом, можно видеть, что взаимодействие этих двух факторов значительно расширяет диапазон напряжений электролита.Однако материалы положительного и отрицательного электрода, выбранные для батареи, не полностью используют окно напряжения электролита LiTFSI WiS. Аккумулятор Mo 6 S 8 / LiFePO 4 [12] и аккумулятор TiS 2 / LiMn 2 O 4 [13] ведут себя аналогично. Следовательно, необходима дальнейшая оптимизация материалов положительного и отрицательного электродов для дальнейшего повышения напряжения и плотности энергии ARLB. Для материалов положительного электрода могут быть выбраны материалы с более высоким потенциалом и / или более высокой удельной емкостью, такие как LiVPO 4 F, LiCoO 2 и LiNi 0.5 Mn 1,5 O 4 . Для отрицательных электродов также могут быть выбраны материалы с более низким потенциалом и / или более высокой удельной емкостью, такие как LiVPO 4 F, TiO 2 и сера.
Для материалов положительного электрода могут быть выбраны материалы с более высоким потенциалом и / или более высокой удельной емкостью, такие как LiVPO 4 F, LiCoO 2 и LiNi 0.5 Mn 1,5 O 4 . Для отрицательных электродов также могут быть выбраны материалы с более низким потенциалом и / или более высокой удельной емкостью, такие как LiVPO 4 F, TiO 2 и сера.
a Окно электрохимической стабильности электролитов LiTFSI-H 2 O с различной концентрацией. b Принципиальная схема эволюции оболочки первичной сольватации Li + в разбавленном растворе и водно-солевом электролите.Воспроизведено с разрешения Ref. [11]. Авторское право 2015, AAAS. c Профили напряжения заряда и разряда полных элементов LiVPO 4 F при различных скоростях. d Длительная цикличность полных ячеек LiVPO 4 F при 20 C. Воспроизведено с разрешения Ref. [14]. Copyright 2017, John Wiley and Sons
Воспроизведено с разрешения Ref. [14]. Copyright 2017, John Wiley and Sons
LiVPO типа таворита 4 F может использоваться в качестве материалов как положительных, так и отрицательных электродов для ARLB [14]. Кривая заряда-разряда при постоянном токе (рис.2в) показывает, что LiVPO 4 F имеет два набора плато заряда и разряда, которые, соответственно, соответствуют интеркаляции и деинтеркаляции ионов лития. Группа с высоким потенциалом соответствует редокс-паре V 4+ / V 3+ (около 4,26 В по сравнению с Li + / Li), а группа с низким потенциалом соответствует V 3+ / V 2+ окислительно-восстановительная пара (около 1,8 В относительно Li + / Li). Используя этот материал как положительный и отрицательный электроды, соответственно, и гелевый электролит LiTFSI «вода-в-соли», гибкий симметричный аккумулятор был собран с 2.Выходное напряжение 46 В (среднее напряжение разряда до 2,4 В), демонстрируя отличные характеристики.
Характеристики симметричной ячейки с 21-метровым электролитом LiTFSI WiS плохие, а кулоновский КПД составляет 96% всего после 50 циклов. Гелевый электролит LiTFSI WiS толщиной 25 мкм был приготовлен путем добавления ПВС, и окно стабильности напряжения было расширено. Собранная таким образом симметричная батарея подвергалась циклическому включению с низкой скоростью 0,2 ° С. Всего за десять циклов кулоновский КПД достиг 100%.При температуре 20 ° C емкость батареи все еще составляла 87% после 4000 циклов, а кулоновский КПД был близок к 100% в течение всего цикла (рис. 2d). Также было впервые обнаружено, что пленка SEI на поверхности материала положительного электрода в электролите LiTFSI WiS представляет собой смесь 49% Li 2 CO 3 и 51% LiF. Это открытие раскрыло секрет того, как Li + может транспортироваться в SEI, поскольку LiF является изолятором как для ионной, так и для электронной проводимости.Если SEI состоит в основном из LiF, очевидно, что он не будет способствовать передаче Li + .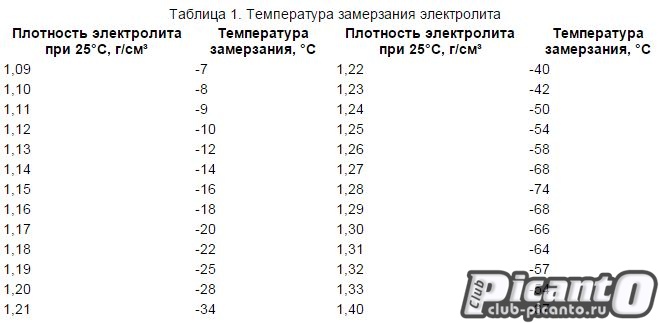 Поскольку Li 2 CO 3 имеет лучшую проводимость, чем LiF, область носителей сверхвысокой концентрации генерируется пространственным зарядом на границе раздела между Li 2 CO 3 и LiF, который является каналом быстрого Li + ионный транспорт. Следовательно, даже в плотной пленке SEI ионы Li + могут быстро переноситься вдоль границы зерен LiF / Li 2 CO 3 , что объясняет хорошие характеристики LiVPO 4 F.Результаты тестирования импеданса переменного тока показывают, что сопротивление интерфейса отрицательного электрода увеличивается только на 50% после 20 циклов, что показывает, что LiF – Li 2 CO 3 –SEI по-прежнему обеспечивает высокую проводимость для ионов Li + . .
Поскольку Li 2 CO 3 имеет лучшую проводимость, чем LiF, область носителей сверхвысокой концентрации генерируется пространственным зарядом на границе раздела между Li 2 CO 3 и LiF, который является каналом быстрого Li + ионный транспорт. Следовательно, даже в плотной пленке SEI ионы Li + могут быстро переноситься вдоль границы зерен LiF / Li 2 CO 3 , что объясняет хорошие характеристики LiVPO 4 F.Результаты тестирования импеданса переменного тока показывают, что сопротивление интерфейса отрицательного электрода увеличивается только на 50% после 20 циклов, что показывает, что LiF – Li 2 CO 3 –SEI по-прежнему обеспечивает высокую проводимость для ионов Li + . .
Многослойный LiCoO 2 электродов обеспечивают удельную емкость 140 мАч g −1 при зарядке до 4,2 В (по сравнению с Li + / Li), что соответствует 50% экстракции Li до Li 0,5 CoO 2 , который считается относительно стабильным материалом положительного электрода в ARLB [15,16,17,18]. В органических электролитах при зарядке до 4,5 В (по сравнению с Li + / Li) достигается более высокая удельная емкость 180 мАч g -1 (соответствует экстракции 70% Li). Однако электрод страдает от серьезного снижения емкости во время циклирования в водных электролитах из-за растворения Co и побочной реакции между Li 0,3 CoO 2 и электролитом. Трис (триметилсилил) борат (TMSB) вводился в электролит WiS в качестве добавки и непрерывно окислялся и разлагался с образованием стабильной межфазной пленки катод-электролит (CEI) на поверхности положительного электрода LiCoO 2 во время процесса зарядки. .Wang et al. обнаружили, что после окисления TMSB образует защитную межфазную поверхность на положительном электроде LiCoO 2 [19]. При высоком напряжении отсечки LiCoO 2 с межфазной защитой обеспечивал высокую емкость 170 мАч g −1 с замечательной стабильностью при циклических нагрузках. ARLB, соединяющий положительный электрод LiCoO 2 с отрицательным электродом из Mo 6 S 8 , показал напряжение холостого хода 2,50 В и напряжение средней точки 1,95 В, достигая плотности энергии до 120 Вт · ч кг -1 и низкой скорость спада емкости 0.
В органических электролитах при зарядке до 4,5 В (по сравнению с Li + / Li) достигается более высокая удельная емкость 180 мАч g -1 (соответствует экстракции 70% Li). Однако электрод страдает от серьезного снижения емкости во время циклирования в водных электролитах из-за растворения Co и побочной реакции между Li 0,3 CoO 2 и электролитом. Трис (триметилсилил) борат (TMSB) вводился в электролит WiS в качестве добавки и непрерывно окислялся и разлагался с образованием стабильной межфазной пленки катод-электролит (CEI) на поверхности положительного электрода LiCoO 2 во время процесса зарядки. .Wang et al. обнаружили, что после окисления TMSB образует защитную межфазную поверхность на положительном электроде LiCoO 2 [19]. При высоком напряжении отсечки LiCoO 2 с межфазной защитой обеспечивал высокую емкость 170 мАч g −1 с замечательной стабильностью при циклических нагрузках. ARLB, соединяющий положительный электрод LiCoO 2 с отрицательным электродом из Mo 6 S 8 , показал напряжение холостого хода 2,50 В и напряжение средней точки 1,95 В, достигая плотности энергии до 120 Вт · ч кг -1 и низкой скорость спада емкости 0.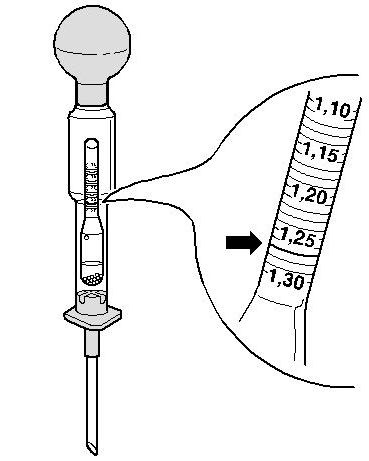 013% за цикл, поскольку защитная межфазная поверхность эффективно подавляет OER и растворение кобальта с положительного электрода в растворе электролита.
013% за цикл, поскольку защитная межфазная поверхность эффективно подавляет OER и растворение кобальта с положительного электрода в растворе электролита.
Промышленная шпинель LiNi 0,5 Mn 1,5 O 4 имеет две кристаллические структуры: P4332 и fd-3 m. Среди них P4332 LiNi 0,5 Mn 1,5 O 4 имеет более высокое плато окислительно-восстановительного потенциала литиирования / делитирования, а из-за высокой концентрации соли в электролите WiS, платформу окислительно-восстановительного потенциала интеркаляции / делитирования LiNi 0.5 Mn 1,5 O 4 имеет положительный сдвиг примерно от 0,2 В до 4,8–5,0 В (по сравнению с Li / Li + ), что находится за пределами окна стабильности электролита WiS. Окислительно-восстановительный потенциал fd-3 m LiNi 0,5 Mn 1,5 O 4 ниже, чем у P4332 LiNi 0,5 Mn 1,5 O 4 . Редокс-потенциал fd-3 m LiNi 0,5 Mn 1,5 O 4 отличается от такового для P4332 LiNi 0,5 Mn 1.5 O 4 , потому что Mn 3+ находится в небольшом количестве в fd-3 м LiNi 0,5 Mn 1,5 O 4 , а ионный радиус Mn 3+ больше этого Mn 4+ , что приводит к расширению решетки и увеличению диффузии Li + . В электролите WIS две платформы напряжения fd-3 m LiNi 0,5 Mn 1,5 O 4 перемещаются до 4,8–5,0 В. Хотя они превышают окно стабильности напряжения электролитов, они могут полностью использовать свои емкости путем регулирования значения pH электролитов, чтобы ингибировать реакцию выделения кислорода.Хорошо известно, что с понижением pH потенциал HER и OER в водных электролитах будет повышаться. Когда 0,1% (в объемных долях) 1 м бис (трифторметилсульфонил) имида (HN (SO 2 CF 3 ) 2 , HTFSI) добавляли в электролит WiS, значение pH электролита WiS уменьшалось до 5, и окно сдвинулось на 0,1 В.
Редокс-потенциал fd-3 m LiNi 0,5 Mn 1,5 O 4 отличается от такового для P4332 LiNi 0,5 Mn 1.5 O 4 , потому что Mn 3+ находится в небольшом количестве в fd-3 м LiNi 0,5 Mn 1,5 O 4 , а ионный радиус Mn 3+ больше этого Mn 4+ , что приводит к расширению решетки и увеличению диффузии Li + . В электролите WIS две платформы напряжения fd-3 m LiNi 0,5 Mn 1,5 O 4 перемещаются до 4,8–5,0 В. Хотя они превышают окно стабильности напряжения электролитов, они могут полностью использовать свои емкости путем регулирования значения pH электролитов, чтобы ингибировать реакцию выделения кислорода.Хорошо известно, что с понижением pH потенциал HER и OER в водных электролитах будет повышаться. Когда 0,1% (в объемных долях) 1 м бис (трифторметилсульфонил) имида (HN (SO 2 CF 3 ) 2 , HTFSI) добавляли в электролит WiS, значение pH электролита WiS уменьшалось до 5, и окно сдвинулось на 0,1 В. Однако самый низкий окислительно-восстановительный потенциал (2,1 В) Mo 6 S 8 все еще выше, чем у HER (1,9 В) электролитов WiS (pH доведен до 5).Положительный материал fd-3 m LiNi 0,5 Mn 1,5 O 4 можно заряжать до 5,05 В (по сравнению с Li + / Li), и он может работать стабильно. Следовательно, можно собрать полные элементы Mo 6 S 8 // LiNi 0,5 Mn 1,5 O 4 , которые имеют среднее напряжение разряда до 2,35 В и плотность энергии 126 Втч кг −1 [20].
Однако самый низкий окислительно-восстановительный потенциал (2,1 В) Mo 6 S 8 все еще выше, чем у HER (1,9 В) электролитов WiS (pH доведен до 5).Положительный материал fd-3 m LiNi 0,5 Mn 1,5 O 4 можно заряжать до 5,05 В (по сравнению с Li + / Li), и он может работать стабильно. Следовательно, можно собрать полные элементы Mo 6 S 8 // LiNi 0,5 Mn 1,5 O 4 , которые имеют среднее напряжение разряда до 2,35 В и плотность энергии 126 Втч кг −1 [20].
Когда 7 м LiOTf (трифторметансульфонат лития) непрерывно добавлялся к 21 м электролитам LiTFSI WiS (обратите внимание, что первоначальный термин «растворять» не подходит, так как невозможно получить такой настоящий водный раствор) для получения «вода в бисальте» (WibS) электролиты, в которых концентрация ионов Li + достигала 28 мкм, соответствующее отношение молекул воды к ионам соли составляло около 2 [21]. Из-за более высокой концентрации соли плотность слоя SEI увеличивалась, а активность воды снижалась, так что он имел более широкое окно электрохимической стабильности около 3,1 В (рис. 3а). На основе этого электролита WibS был приготовлен ARLB с TiO 2 в качестве отрицательного электрода и LiMn 2 O 4 в качестве положительного электрода, с напряжением холостого хода 2,5 В, плато напряжения 2,07 В и энергией плотность 100 Вт · ч кг −1 (рассчитано исходя из суммарной массы электродов) (рис.3б). Электролит WibS на основе ацетата был создан путем смешивания неорганических солей LiOAc и KOAc, у которых отношение воды к катионам составляло всего 1,3 [22]. Результаты показывают, что обычные материалы отрицательного электрода, такие как Li 4 Ti 5 O 12 и TiO 2 , могут обратимо интеркалировать / деинтеркалировать Li + в этом электролите WibS, а собранный TiO 2 / Mn 2 O 4 ARLB имеет плоское разрядное плато 2,10 В (рис.
Из-за более высокой концентрации соли плотность слоя SEI увеличивалась, а активность воды снижалась, так что он имел более широкое окно электрохимической стабильности около 3,1 В (рис. 3а). На основе этого электролита WibS был приготовлен ARLB с TiO 2 в качестве отрицательного электрода и LiMn 2 O 4 в качестве положительного электрода, с напряжением холостого хода 2,5 В, плато напряжения 2,07 В и энергией плотность 100 Вт · ч кг −1 (рассчитано исходя из суммарной массы электродов) (рис.3б). Электролит WibS на основе ацетата был создан путем смешивания неорганических солей LiOAc и KOAc, у которых отношение воды к катионам составляло всего 1,3 [22]. Результаты показывают, что обычные материалы отрицательного электрода, такие как Li 4 Ti 5 O 12 и TiO 2 , могут обратимо интеркалировать / деинтеркалировать Li + в этом электролите WibS, а собранный TiO 2 / Mn 2 O 4 ARLB имеет плоское разрядное плато 2,10 В (рис. 3в). Электролит недорогой, экологически чистый, легко регулируемый, легко адаптируемый и универсальный.
3в). Электролит недорогой, экологически чистый, легко регулируемый, легко адаптируемый и универсальный.
a Электрохимические окна электролитов WibS и WiS при скорости сканирования 10 мВ с −1 и первые следы CV активных электродов (C-TiO 2 и LiMn 2 O 4 ) при скорости сканирования 0,1 мВ с −1 в электролитах WibS. b Профили заряда-разряда аккумуляторов C-TiO 2 / LiMn 2 O 4 в 5-м и 100-м циклах.Воспроизведено с разрешения Ref. [21]. Авторское право 2016, Wiley – VCH. c Профиль заряда-разряда c-TiO 2 / LiMn 2 O 4 батарей при 0,5 C в электролитах WibS на основе ацетата. Воспроизведено с разрешения Ref. [22]. Авторское право 2018, Королевское химическое общество
Электролиты гидрат-расплав
Определение плавления гидратов аналогично определению WibS. Фактически, конструкция электролита WibS была вдохновлена электролитом гидрат-расплав [23]. Электролит гидрат-расплав фактически является продолжением сверхконцентрированного электролита в системе, в которой вода является растворителем. Суперконцентрированные электролиты используются в литий-ионных батареях. Было обнаружено, что они могут не только улучшить стабильность батарей, но и увеличить рабочее напряжение (4 В). Эта концепция была впервые применена Yamada et al. для водных систем хранения энергии и известен как «гидрат-расплав». Исследовали эвтектический состав солей лития Li (SO 2 CF 3 ) 2 (LiTFSI) и солей лития Li (SO 2 C 2 F 5 ) 2 (LiBETI), оба имеют органический имидный анион.Результаты показывают, что, когда состав представляет собой Li (TFSI) 0,7 (BETI) 0,3 , растворимость смеси с водой является максимальной, может быть получен стабильный прозрачный раствор, а концентрация молекулы воды составляет всего 10,1 м ( Рис. 4а). Большое количество анионов TFSI / BETI изолируют свободные молекулы воды друг от друга, и все молекулы воды могут участвовать в гидратной оболочке из ионов лития, тем самым снижая активность молекул воды и расширяя окно электрохимической стабильности электролитов.
Электролит гидрат-расплав фактически является продолжением сверхконцентрированного электролита в системе, в которой вода является растворителем. Суперконцентрированные электролиты используются в литий-ионных батареях. Было обнаружено, что они могут не только улучшить стабильность батарей, но и увеличить рабочее напряжение (4 В). Эта концепция была впервые применена Yamada et al. для водных систем хранения энергии и известен как «гидрат-расплав». Исследовали эвтектический состав солей лития Li (SO 2 CF 3 ) 2 (LiTFSI) и солей лития Li (SO 2 C 2 F 5 ) 2 (LiBETI), оба имеют органический имидный анион.Результаты показывают, что, когда состав представляет собой Li (TFSI) 0,7 (BETI) 0,3 , растворимость смеси с водой является максимальной, может быть получен стабильный прозрачный раствор, а концентрация молекулы воды составляет всего 10,1 м ( Рис. 4а). Большое количество анионов TFSI / BETI изолируют свободные молекулы воды друг от друга, и все молекулы воды могут участвовать в гидратной оболочке из ионов лития, тем самым снижая активность молекул воды и расширяя окно электрохимической стабильности электролитов. В этом растворе все молекулы воды координированы с ионами лития, а внутримолекулярные водородные связи почти не заметны (рис. 4б). Кроме того, было обнаружено, что равновесный потенциал реакции внедрения / расслоения иона лития составлял 0,25 В в электролите гидрат-расплав, что было больше, чем значение в 22-метровом LiTFSI (рис. 4с). Термодинамический механизм (который снижает уровни ВЗМО) и кинетический механизм (пассивация, вызванная анионами) дополнительно увеличивают разность потенциалов между анодом и катодом, тем самым расширяя окно напряжения до 3.8 В (рис. 4г). На основе электролита гидрат-расплав, Li 4 Ti 5 O 12 // LiCoO 2 и Li 4 Ti 5 O 12 // LiNi 0,5 Mn 1,5 O 4 полных ARLB были установлены, которые показали плато высокого напряжения разрядной ячейки при 2,26 В и 3,10 В, соответственно. До сих пор существует немного других исследований по применению электролитов расплава гидрата в водных батареях.
В этом растворе все молекулы воды координированы с ионами лития, а внутримолекулярные водородные связи почти не заметны (рис. 4б). Кроме того, было обнаружено, что равновесный потенциал реакции внедрения / расслоения иона лития составлял 0,25 В в электролите гидрат-расплав, что было больше, чем значение в 22-метровом LiTFSI (рис. 4с). Термодинамический механизм (который снижает уровни ВЗМО) и кинетический механизм (пассивация, вызванная анионами) дополнительно увеличивают разность потенциалов между анодом и катодом, тем самым расширяя окно напряжения до 3.8 В (рис. 4г). На основе электролита гидрат-расплав, Li 4 Ti 5 O 12 // LiCoO 2 и Li 4 Ti 5 O 12 // LiNi 0,5 Mn 1,5 O 4 полных ARLB были установлены, которые показали плато высокого напряжения разрядной ячейки при 2,26 В и 3,10 В, соответственно. До сих пор существует немного других исследований по применению электролитов расплава гидрата в водных батареях. Недавно Wu et al. применили электролиты к батареям Li-O 2 , которые, как было показано, эффективно предотвращают разложение растворителя и образование побочных продуктов, тем самым увеличивая срок службы Li-O 2 батарей [24].Для дальнейшей оценки и улучшения применимости электролита необходимы все более и более глубокие исследования.
Недавно Wu et al. применили электролиты к батареям Li-O 2 , которые, как было показано, эффективно предотвращают разложение растворителя и образование побочных продуктов, тем самым увеличивая срок службы Li-O 2 батарей [24].Для дальнейшей оценки и улучшения применимости электролита необходимы все более и более глубокие исследования.
a Линия ликвидуса смесей LiTFSI + LiBETI в воде. b Первопринципный DFTMD моделирует снимок равновесной траектории Li (TFSI) 0,7 (BETI) 0,3 · 2H 2 O гидратный расплав и разбавленный LiTFSI / H 2 O. c Взаимосвязь между изменение равновесного потенциала интеркаляции лития и Li + -концентрации электролитов. d Окна напряжений обычных электролитов LiTFSI / H 2 O и гидратированных электролитов расплава, а также окислительно-восстановительный потенциал Li 4 Ti 5 O 12 , LiCoO 2 , LiNi 0,5 Mn 1.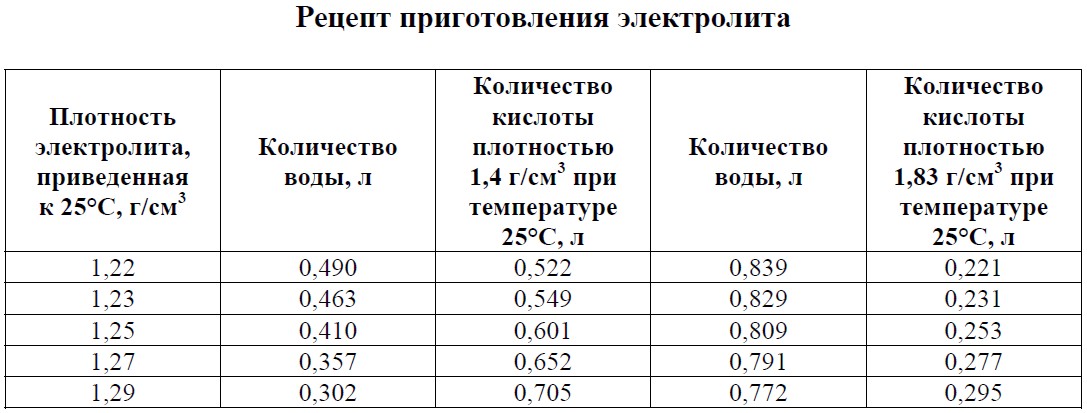 5 O 4 в гидратированных электролитах расплава. Воспроизведено с разрешения Ref. [23]. Copyright 2016, Nature Publishing Group
5 O 4 в гидратированных электролитах расплава. Воспроизведено с разрешения Ref. [23]. Copyright 2016, Nature Publishing Group
Гибридный водный / неводный электролит (HANE)
Путем введения неводного растворителя, диметилкарбоната (DMC), в электролит WiS, гибридный водно-неводный электролит (HANE) с расширенным электрохимическим окном 4.1 В. Это нейтральный растворитель, который менее чувствителен к отталкиванию отрицательного электрода и, следовательно, легче участвует в межпространственной химии, чем анионы [25]. На основе этого гибридного электролита был создан ARLB, состоящий из положительного электрода LiNi 0,5 Mn 1,5 O 4 и отрицательного электрода Li 4 Ti 5 O 12 . Этот ARLB с плоским плато разряда при 3,2 В (рис. 5a) имел плотность энергии до 165 Вт · ч · кг −1 и стабильность при циклическом изменении более 1000 циклов (рис.5б). В аналогичном подходе также сообщалось о гибридной системе «ацетонитрил (AN) / вода-в-соли» электролита (AN – WiS), обеспечивающей повышенную ионную проводимость, пониженную вязкость и расширенный диапазон температур [26].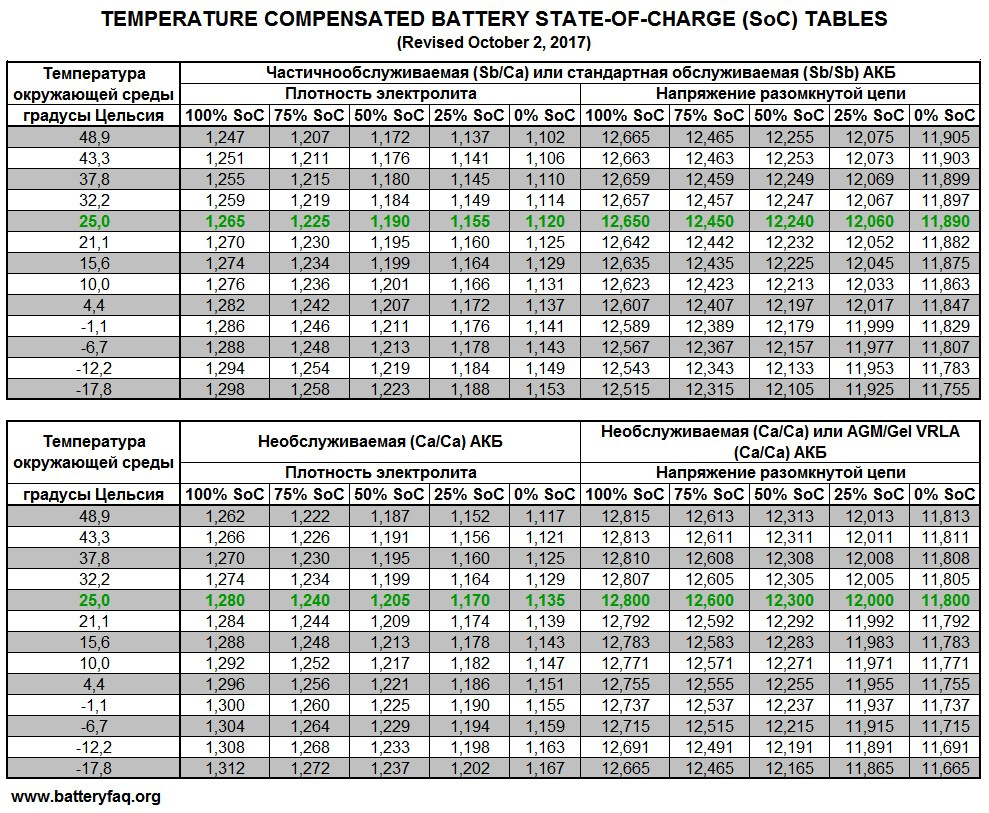 Увеличение концентрации соли LiTFSI в AN – WiS до уровня сверхконцентрации (15,3 м) расширяет окно электрохимической стабильности до 4,5 В [27]. Этот AN – WiSE активировал ARLB, например Li 4 Ti 5 O 12 / LiMn 2 O 4 и Li 4 Ti 5 O 12 / LiNi 0.8 Co 0,15 Al 0,05 O 2 полных батарей, с высоким напряжением, высокой плотностью энергии и отличными характеристиками при езде на велосипеде.
Увеличение концентрации соли LiTFSI в AN – WiS до уровня сверхконцентрации (15,3 м) расширяет окно электрохимической стабильности до 4,5 В [27]. Этот AN – WiSE активировал ARLB, например Li 4 Ti 5 O 12 / LiMn 2 O 4 и Li 4 Ti 5 O 12 / LiNi 0.8 Co 0,15 Al 0,05 O 2 полных батарей, с высоким напряжением, высокой плотностью энергии и отличными характеристиками при езде на велосипеде.
a Кривые разряда ячейки LTO-LNMO при различных скоростях. b Циклические характеристики полных ячеек LTO-LNMO при 6 ° C. Воспроизведено с разрешения Ref. [25]. Copyright 2018, Elsevier B.V. c Сравнение напряжения завершения зарядки различных солей для ARLB. d Зарядно-разрядные кривые ячейки TiO 2 / LiMn 2 O 4 при 5 C; вставленный график — это циклическая производительность батареи [28]. Воспроизведено с разрешения Ref. [28]. Авторские права 2018, Nature Publishing Group
Воспроизведено с разрешения Ref. [28]. Авторские права 2018, Nature Publishing Group
Электролит вода в иономере
Новый тип электролитов «вода в иономере» был представлен He et al. [28]. Электролит «вода в иономере», содержащий 50 мас.% Иономера, имеет окно электрохимической стабильности 2,7 В (рис. 5c). Полный элемент LiTi 2 (PO 4 ) 3 / LiMn 2 O 4 на основе этого электролита показал отличные циклические характеристики и обеспечил среднее напряжение разряда> 1.5 В и удельной энергией 77 Втч кг −1 . Кроме того, с использованием алюминиевого токосъемника была получена полная батарея TiO 2 / LiMn 2 O 4 со средним выходным напряжением 2,1 В и начальной удельной энергией 124,2 Вт · ч кг -1 (рис. 5d). .
Роль SEI
Разложение добавок к электролиту
Добавление добавок к электролиту также может формировать защитную, подобную SEI межфазную фазу на месте. Добавки должны отвечать следующим требованиям: (1) иметь химическую стабильность, то есть стабильность в данном растворе электролита, и (2) иметь электрохимическую стабильность, чтобы электрохимический процесс мог происходить во время разложения с образованием межфазных компонентов.
Добавки должны отвечать следующим требованиям: (1) иметь химическую стабильность, то есть стабильность в данном растворе электролита, и (2) иметь электрохимическую стабильность, чтобы электрохимический процесс мог происходить во время разложения с образованием межфазных компонентов.
Гель LiTFSI-HFE (высокофторированный эфир) был нанесен на поверхности отрицательных электродов в качестве межфазного покрытия-предшественника, которое было использовано для получения твердой межфазной границы, состоящей как из органических фторированных углеводородов, так и неорганических фторидов, что позволило получить высокую емкость / низкую производительность. потенциальные материалы отрицательного электрода (такие как кремний, графит и металлический Li) для обратимого цикла в гелевых полимерных электролитах (GPE) 21 м LiTFSI + 7 м LiOTf WibS (рис. 6a) [29]. Соединение отрицательных электродов с покрытием с различными материалами положительных электродов, серия из 4 штук.Были получены ARLB 0 В с высокой эффективностью и обратимостью, сопоставимые с коммерческими литий-ионными батареями (рис.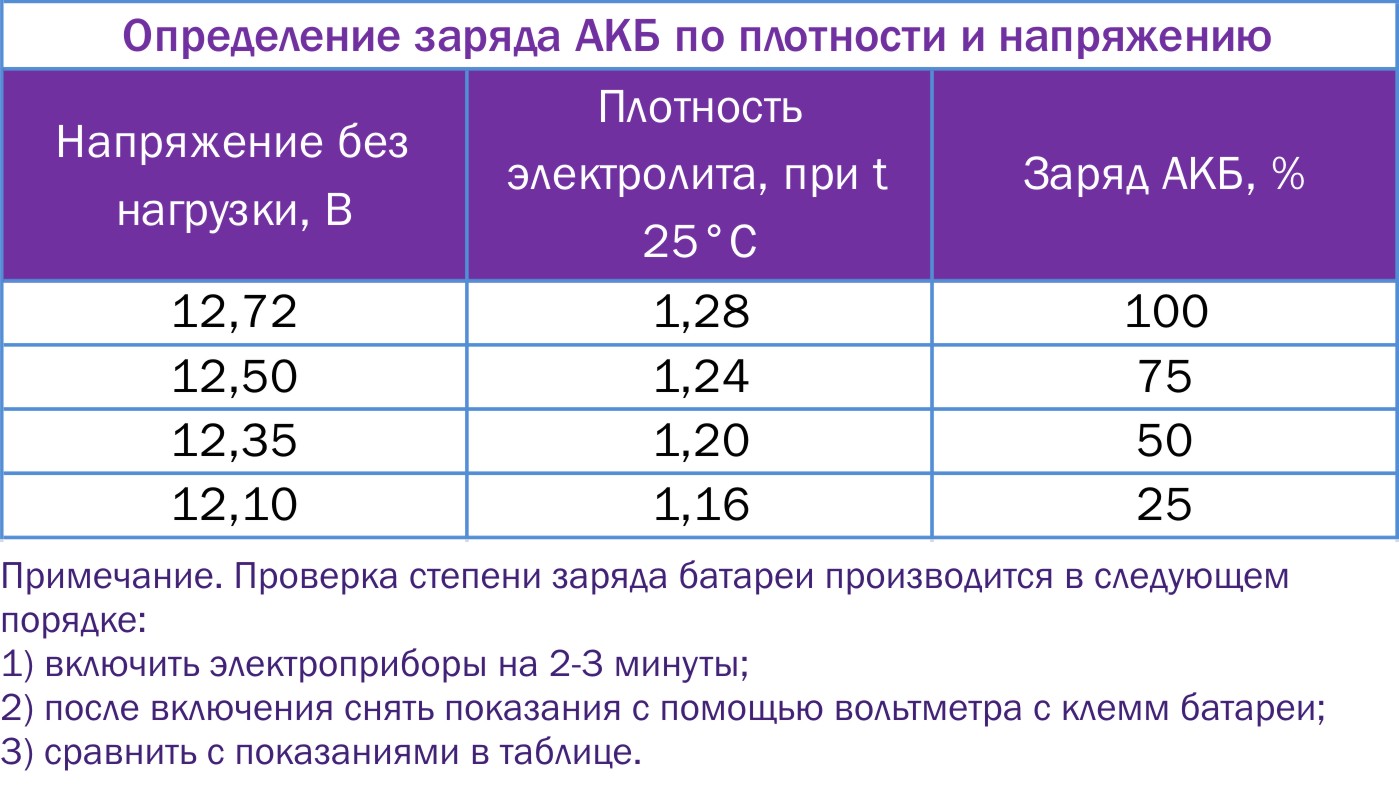 6b – d). Кроме того, ARLB со сверхвысокой плотностью энергии 460 Вт · ч кг -1 был разработан путем соединения отрицательного электрода из гелевого графита HFE и положительного электрода типа преобразования интеркаляционного типа (LiBr 0,5 Cl 0,5 ) из графита (LBC –G) (рис. 6д, е) [30].
6b – d). Кроме того, ARLB со сверхвысокой плотностью энергии 460 Вт · ч кг -1 был разработан путем соединения отрицательного электрода из гелевого графита HFE и положительного электрода типа преобразования интеркаляционного типа (LiBr 0,5 Cl 0,5 ) из графита (LBC –G) (рис. 6д, е) [30].
a Зарядно-разрядные кривые графитовых электродов, предварительно покрытых гелем LiTFSI-HFE.Профили напряжения b Li / LiVPO 4 F батарей, c графитовых / LiVPO 4 F батарей и d Li / LiMn 2 O 4 батарей при 0,3 C. e Типичные кривые заряда-разряда (третьи циклы) аккумуляторов графит // LiBr / LiCl (синий) или графитовых // аккумуляторов с моногидратами LiBr / LiCl (красный). f Устойчивость этих полностью заряженных аккумуляторов во время езды на велосипеде. Воспроизведено с разрешения Ref. [29]. Авторские права 2017, Elsevier B. V. г Схематическое изображение металлического лития LISICON с пленочным покрытием. ч Кривая постоянного тока заряда-разряда Li / LiMn 2 O 4 аккумуляторов в первом цикле. Воспроизведено с разрешения Ref. [31]. Авторское право 2013, Исследования природы. i Кривые постоянного тока заряда-разряда во втором и десятом циклах Li / LiCoO 2 батареи. Воспроизведено с разрешения Ref. [32]. Copyright 2013, Королевское химическое общество
V. г Схематическое изображение металлического лития LISICON с пленочным покрытием. ч Кривая постоянного тока заряда-разряда Li / LiMn 2 O 4 аккумуляторов в первом цикле. Воспроизведено с разрешения Ref. [31]. Авторское право 2013, Исследования природы. i Кривые постоянного тока заряда-разряда во втором и десятом циклах Li / LiCoO 2 батареи. Воспроизведено с разрешения Ref. [32]. Copyright 2013, Королевское химическое общество
Искусственный SEI
Для реализации функционального металлического литиевого электрода в водной электролитной системе на его поверхность можно нанести тонкий и компактный защитный слой раздела или искусственный SEI.Этот искусственный SEI должен не только иметь высокую ионную проводимость, чтобы можно было проводить электрохимический процесс, но и предотвращать проникновение воды, чтобы молекулы воды не могли проходить сквозь него, чтобы избежать реакции между молекулами воды и металлическим литием.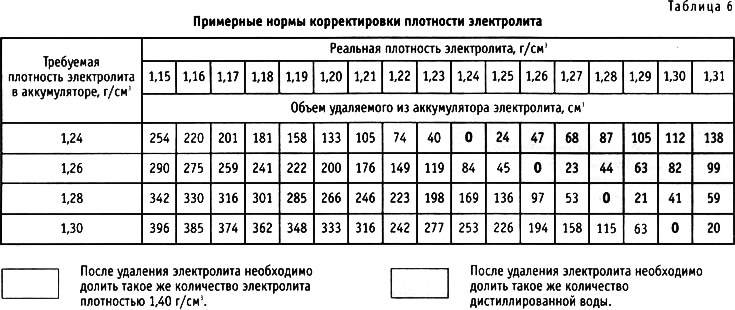
Наша группа представила пленку литиевого суперионного проводника (LISICON) на отрицательном электроде из металлического лития (рис. 6g) [31]. В этом исследовании LISICON служил комбинированным сепаратором и твердым электролитом с ионной проводимостью при комнатной температуре около 0.1 мСм см −1 . С LiMn 2 O 4 в качестве положительного электрода и 0,5 M Li 2 SO 4 (единица M — традиционная молярная концентрация, которая составляет моль л -1 ) в качестве электролитов, ионы лития переносятся через водный электролит со стороны положительного электрода, пройти через слой покрытия LISICON и достичь отрицательного электрода из металлического лития. Благодаря низкому потенциалу зачистки / металлизации металлического лития рабочее напряжение полученных ARLB увеличилось до более чем 4 В с плато на уровне 4.06 В и 3,85 В (рис. 6h). Подобные высоковольтные ARLB с высокой плотностью энергии также были разработаны на основе гелевой полимерной мембраны с литиево-металлическим графитовым отрицательным электродом с покрытием LISICON и положительным электродом LiCoO 2 / LiFePO 4 [32, 33].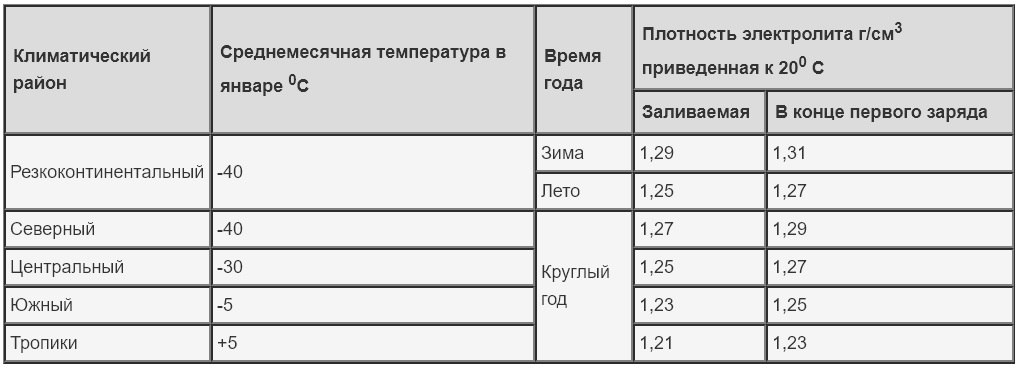 Однако неудовлетворительная ионная проводимость LISICON может стать проблемой для достижения хороших скоростных характеристик. Ионная проводимость электрода со структурой перовскита, Al-замещенного литий-лантана-титанита (A-LLTO), разработанного Ле и соавторами, была увеличена до 0.317 мСм см −2 , что намного больше, чем 0,1 мСм см −2 , полученное с помощью LISICON [34]. Когда A-LLTO применялся в качестве искусственного SEI к отрицательному электроду из металлического лития, и он был объединен с положительным электродом LiCoO 2 , полученный ARLB имел напряжение холостого хода почти 4,2 В и высокую удельную емкость 164 мА · ч. −1 при 0,1 C (рис. 6i). Тем не менее, его скоростные характеристики все еще не были сопоставимы с характеристиками обычных ARLB, и проблема низкой ионной проводимости искусственного SEI все еще требует решения.Более того, для создания искусственного SEI на поверхности металлического лития обычно требуется дополнительный слой для предотвращения прямого контакта между металлическим литием и проводящим разделительным слоем (LISICON, A-LLTO, LATP и т.
Однако неудовлетворительная ионная проводимость LISICON может стать проблемой для достижения хороших скоростных характеристик. Ионная проводимость электрода со структурой перовскита, Al-замещенного литий-лантана-титанита (A-LLTO), разработанного Ле и соавторами, была увеличена до 0.317 мСм см −2 , что намного больше, чем 0,1 мСм см −2 , полученное с помощью LISICON [34]. Когда A-LLTO применялся в качестве искусственного SEI к отрицательному электроду из металлического лития, и он был объединен с положительным электродом LiCoO 2 , полученный ARLB имел напряжение холостого хода почти 4,2 В и высокую удельную емкость 164 мА · ч. −1 при 0,1 C (рис. 6i). Тем не менее, его скоростные характеристики все еще не были сопоставимы с характеристиками обычных ARLB, и проблема низкой ионной проводимости искусственного SEI все еще требует решения.Более того, для создания искусственного SEI на поверхности металлического лития обычно требуется дополнительный слой для предотвращения прямого контакта между металлическим литием и проводящим разделительным слоем (LISICON, A-LLTO, LATP и т. Д.), Поскольку последний в противном случае был бы восстановлены металлическим литием из-за их химической нестабильности. Дополнительный слой обычно представляет собой гелевый полимерный электролит, состоящий из такого тонкого полимерного слоя (PVDF / PMMA / PVDF и PEO и т. Д.), Насыщенного органическими электролитами (1 M LiClO 4 в EC / DMC).
Д.), Поскольку последний в противном случае был бы восстановлены металлическим литием из-за их химической нестабильности. Дополнительный слой обычно представляет собой гелевый полимерный электролит, состоящий из такого тонкого полимерного слоя (PVDF / PMMA / PVDF и PEO и т. Д.), Насыщенного органическими электролитами (1 M LiClO 4 в EC / DMC).
Система перезаряжаемых Ni – Li батарей была изготовлена с использованием 1 M LiClO 4 в этиленкарбонате / диметилкарбонате (EC / DMC) в качестве органических электролитов для металлического литиевого отрицательного электрода и 1 M LiOH + 1 M KOH в качестве водных электролитов. для положительного электрода Ni (OH) 2 [35]. Органический и водный электролиты были разделены тонкой пленкой LISICON. Батарея имела напряжение плато 3,47 В и удельную емкость 268 мАч g -1 , что приводило к очень высокой плотности энергии 935 Втч кг -1 на основе объединенной массы активных материалов.В этой батарее использовались положительный электрод NiO / CNT конверсионного типа и отрицательный металлический литиевый электрод с гибридным водно-органическим электролитом, разделенные литий-ионной проводящей пленкой LATP (Li 1+ x + y Al x Ti 2- x Si y P 3- y O 12 ) [36].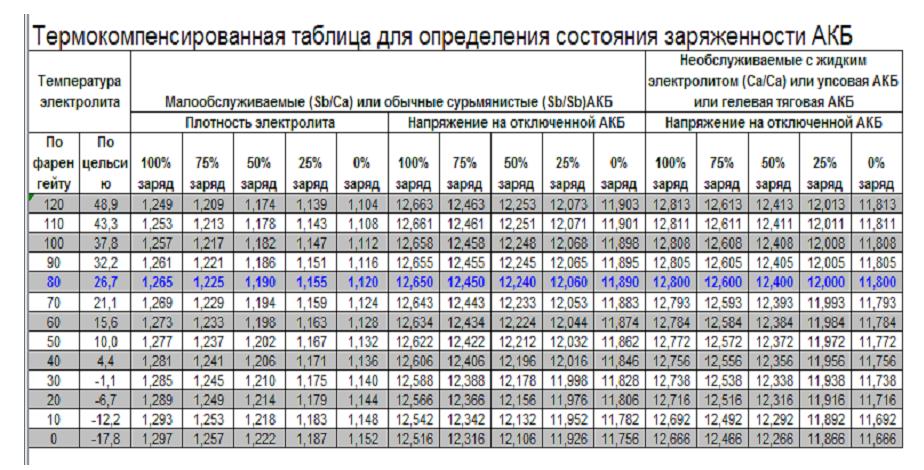 У него было стабильное плато разряда при 3,38 В, но необходимы дальнейшие разработки, чтобы повысить его устойчивость к циклическим нагрузкам.
У него было стабильное плато разряда при 3,38 В, но необходимы дальнейшие разработки, чтобы повысить его устойчивость к циклическим нагрузкам.
Использование отрицательных материалов с высокой удельной емкостью или низким окислительно-восстановительным потенциалом
Водная перезаряжаемая гибридная батарея (ARHB) с положительным электродом LiMn 2 O 4 и отрицательным электродом из металла Zn была впервые предложена в 2012 году и работает примерно при 2 В, демонстрируя приемлемую плотность энергии (50–80 Вт · ч, кг –1 ) и хорошие характеристики при циклическом режиме (сохранение емкости 95% после 4000 циклов) [37]. Однако его электрохимические свойства, такие как кулоновский КПД, нуждаются в дальнейшем улучшении.К настоящему времени были приняты следующие меры: (1) модификация поверхности и защита материалов положительных электродов; (2) улучшение электролитов; и (3) обработка цинкового отрицательного электрода.
Из-за низкой проводимости LiMn 2 O 4 и структурных изменений, вызванных искажением Яна – Теллера, гибридная батарея Zn / LiMn 2 O 4 имеет низкие энергетические характеристики и подвергается серьезной деградации емкости.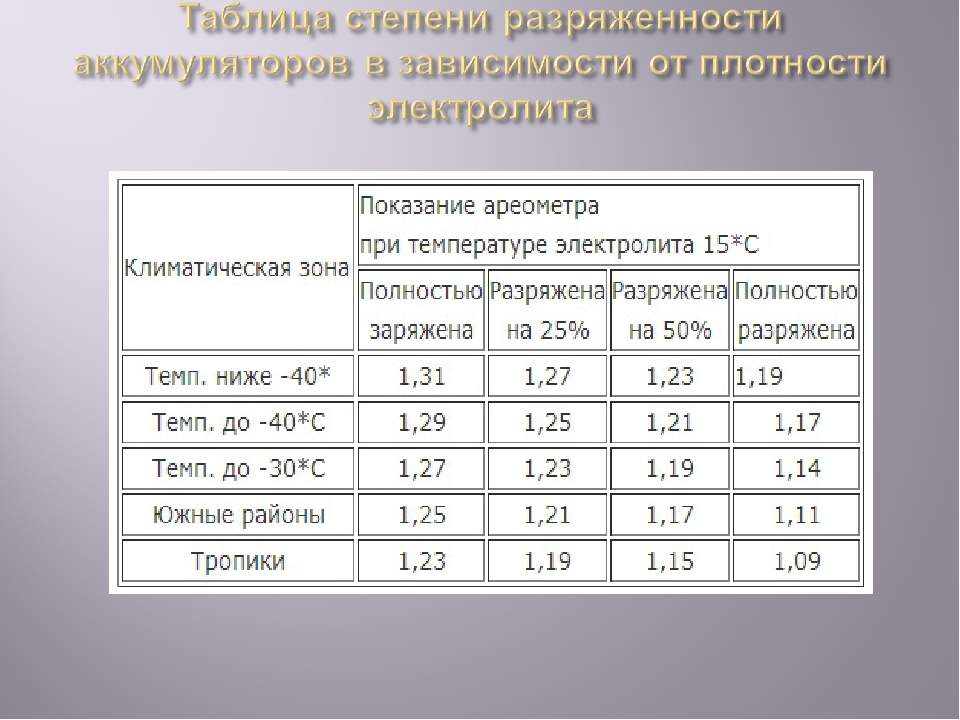 Поскольку углерод обычно может использоваться для изготовления композитов, было обнаружено, что использование графеновых пленок в качестве искусственных SEI на поверхности LiMn 2 O 4 эффективно подавляет структурные искажения LiMn 2 O 4 и значительно увеличивает ионную проводимость LiMn 2 O 4 , тем самым улучшая цикличность и быстродействие гибридной батареи [38, 39].
Поскольку углерод обычно может использоваться для изготовления композитов, было обнаружено, что использование графеновых пленок в качестве искусственных SEI на поверхности LiMn 2 O 4 эффективно подавляет структурные искажения LiMn 2 O 4 и значительно увеличивает ионную проводимость LiMn 2 O 4 , тем самым улучшая цикличность и быстродействие гибридной батареи [38, 39].
Из-за ограничения окна электрохимической стабильности, образования дендритов цинка и коррозии отрицательного цинкового электрода модификация электролита является еще одним эффективным способом улучшения электрохимических характеристик водного раствора Zn / LiMn 2 O 4 гибридных аккумулятора . Многие добавки, включая тиомочевину (TU) [40], SiO 2 [41], циклодекстрин (CD) [42] и коллоидный диоксид кремния (FS) [43], были введены в электролит для улучшения электрохимических характеристик гибридных батареи. Хотя есть некоторые улучшения, эффекты все еще неудовлетворительны, и требуется дальнейшее улучшение.
Хотя есть некоторые улучшения, эффекты все еще неудовлетворительны, и требуется дальнейшее улучшение.
Недавно Ван и его сотрудники сообщили об электролите WiS, состоящем из 1 м Zn (TFSI) 2 + 20 м LiTFSI, в котором цинковый отрицательный электрод является очень обратимым. Гибридная батарея Zn / LiMn 2 O 4 достигла наивысшей плотности энергии, когда массовое отношение Zn / LiMn 2 O 4 было уменьшено до 0,25: 1. Кроме того, кривые заряда / разряда для разных циклов гибридной батареи в значительной степени совпадают, что показывает ее хорошую электрохимическую обратимость.При температуре 4 ° C сохранение емкости после 4000 циклов составило 85%, при этом CE достигает 99,9%, что лучше, чем все ранее описанные работы с Zn – Li-батареями [44]. Однако высокая стоимость использования больших количеств органической соли может препятствовать применению смешанных Zn / Li-ионных аккумуляторов в крупномасштабных системах хранения энергии.
Сообщалось о новом электролите «глубокая эвтектическая вода (WiDES)», который может ингибировать реакцию отрицательного цинкового электрода, уменьшать коррозию и пассивацию цинкового отрицательного электрода, увеличивать коэффициент использования цинка, и улучшить жизненный цикл [45].Следовательно, гибридная батарея Zn / LiMn 2 O 4 , в которой используется этот электролит WiDES, демонстрирует отличные характеристики при циклической работе.
В дополнение к LiMn 2 O 4 , другие коммерческие материалы для положительных электродов для литий-ионных батарей, такие как LiFePO 4 , LiNi 1/3 Co 1/3 Mn 1/3 O 2 , Li 3 V 2 (PO 4 ) 3 (LVP) и LiMn 0,8 Fe 0,2 PO 4 , также были изучены в качестве материалов потенциальных положительных электродов для водных аккумуляторов. Zn – Li гибридные батареи. Поскольку в нескольких статьях рассматривалась соответствующая работа в этой области, мы не будем здесь подробно останавливаться. Эти работы сведены в Таблицу 1 и Рис. 7а.
Поскольку в нескольких статьях рассматривалась соответствующая работа в этой области, мы не будем здесь подробно останавливаться. Эти работы сведены в Таблицу 1 и Рис. 7а.
Плотность энергии и средняя разрядная емкость различных a ARLB, b ASIB, AKIBS и ANIB с высоким напряжением и плотностью энергии
Водные Na-ионные батареи
Развитие водных натрий-ионных батарей (ASIB) в основном связано с тем фактом, что ресурсы натрия в земной коре намного больше, чем ресурсы лития.Кроме того, существует множество материалов для положительных и отрицательных электродов для ASIB, которые показывают очень хорошие электрохимические характеристики [49,50,51,52]. О ходе исследований электродных материалов написано много обзоров, и они также всеобъемлющи [3, 6, 9]. Однако нет никаких систематических исследований того, как построить ASIB с высокой плотностью энергии. В таблице 2 и на рис. 7b представлены подробные сведения о характеристиках ASIB, о которых сообщалось на сегодняшний день.
В таблице 2 и на рис. 7b представлены подробные сведения о характеристиках ASIB, о которых сообщалось на сегодняшний день.
Как упоминалось выше, есть два способа улучшить удельную энергию химического состава водных аккумуляторов.Первый заключается в расширении диапазона напряжений, а другой — в выборе подходящих материалов для отрицательного и положительного электродов с большой разностью потенциалов и высокой удельной емкостью.
Сверхконцентрированные электролиты
Разработка соответствующих натриевых электролитов WiS остается серьезной проблемой для разработки натрий-ионных батарей в водных растворах, поскольку существующие натриевые электролиты еще не отвечают требованиям высокой растворимости солей, содержащих химические источники (фтор). -содержащие соли), высокая химическая и электрохимическая стабильность в воде. Подобно ARLB, электролиты WiS также можно наносить на ASIB для расширения электрохимического окна. Установлено, что сила между Na + и TFSI — намного сильнее, чем сила между Li + и TFSI —, поэтому, хотя водный раствор соли NaTFSI может достигать только 9,26 м, он может образовывать SEI проводимости Na + , а окно электрохимической стабильности может достигать 2,5 В [53]. На основе этого электролита NaTi 2 (PO 4 ) 3 // Na 0.66 [Mn 0,66 Ti 0,34 ] O 2 была собрана полная батарея со стабильной циклической производительностью и удельной энергией 31 Втч кг -1 . При комнатной температуре концентрации растворов трифторида натрия (NaOTf) и бис (трифторметансульфонил) имида (NaTFSI) низкие (9–10 м), и нельзя полностью использовать преимущества суперконцентрированных электролитов. Следовательно, для дальнейшего развития высоковольтных ASIB необходимы соответствующие натриевые соли для производства высококонцентрированных электролитов WiS.
Подобно ARLB, электролиты WiS также можно наносить на ASIB для расширения электрохимического окна. Установлено, что сила между Na + и TFSI — намного сильнее, чем сила между Li + и TFSI —, поэтому, хотя водный раствор соли NaTFSI может достигать только 9,26 м, он может образовывать SEI проводимости Na + , а окно электрохимической стабильности может достигать 2,5 В [53]. На основе этого электролита NaTi 2 (PO 4 ) 3 // Na 0.66 [Mn 0,66 Ti 0,34 ] O 2 была собрана полная батарея со стабильной циклической производительностью и удельной энергией 31 Втч кг -1 . При комнатной температуре концентрации растворов трифторида натрия (NaOTf) и бис (трифторметансульфонил) имида (NaTFSI) низкие (9–10 м), и нельзя полностью использовать преимущества суперконцентрированных электролитов. Следовательно, для дальнейшего развития высоковольтных ASIB необходимы соответствующие натриевые соли для производства высококонцентрированных электролитов WiS.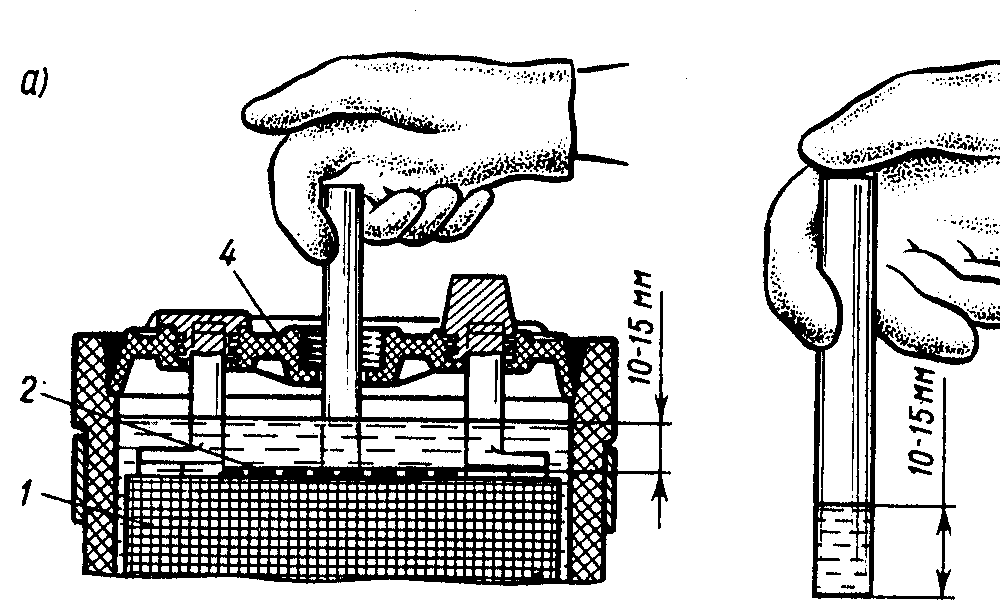 Установлено, что NaFSI имеет высокую растворимость (до 37 моль) в водном растворе и стабильное электрохимическое окно 2,6 В при концентрации до 35 моль. Дальнейшие исследования показывают, что катоды из NaTi 2 (PO 4 ) 3 и катоды из Na 3 (VOPO 4 ) 2 F могут использоваться в ASIB с напряжением более 2 В [54] . Смешанные катионные смеси динатрия могут использоваться для приготовления электролитов с более высокими концентрациями, например, 9 м NaOTf + 8 м KOTf и 22 м KOTf + 4 м NaOTf.Однако присутствие нескольких катионов может привести к встраиванию смешанных катионов в материал электрода, влияя на характеристики элемента. Для решения этой проблемы исследователи разработали новый класс WiS-электролитов с поддержкой взаимодействия, содержащих соли трифторида тетраэтиламмония (TEAOTf), которые из-за большого ионного радиуса TEA + трудно внедрить в большинство электродных материалов [включая прусские Синий аналог (PBA)], что позволяет избежать совместной интеркаляции мультикатионов в циклическом процессе [55].
Установлено, что NaFSI имеет высокую растворимость (до 37 моль) в водном растворе и стабильное электрохимическое окно 2,6 В при концентрации до 35 моль. Дальнейшие исследования показывают, что катоды из NaTi 2 (PO 4 ) 3 и катоды из Na 3 (VOPO 4 ) 2 F могут использоваться в ASIB с напряжением более 2 В [54] . Смешанные катионные смеси динатрия могут использоваться для приготовления электролитов с более высокими концентрациями, например, 9 м NaOTf + 8 м KOTf и 22 м KOTf + 4 м NaOTf.Однако присутствие нескольких катионов может привести к встраиванию смешанных катионов в материал электрода, влияя на характеристики элемента. Для решения этой проблемы исследователи разработали новый класс WiS-электролитов с поддержкой взаимодействия, содержащих соли трифторида тетраэтиламмония (TEAOTf), которые из-за большого ионного радиуса TEA + трудно внедрить в большинство электродных материалов [включая прусские Синий аналог (PBA)], что позволяет избежать совместной интеркаляции мультикатионов в циклическом процессе [55]. Этот активированный взаимодействием электролит WiS имеет концентрацию до 31 м (9 м NaOTf – 22 м TEAOTf) и окно электрохимической стабилизации до 3,3 В (рис. 8a). A Na 1,88 Mn [Fe (CN) 6 ] 0,97 · 1,35H 2 O // IC-WiS на основе Na // NaTiOPO 4 Полная батарея с высоким напряжением отсечки (2,5 В) и Установлена высокая плотность энергии 71 Втч кг -1 , которая показала выдающуюся стабильность при циклическом изменении как на низких, так и на высоких скоростях (рис. 8b – e).
Этот активированный взаимодействием электролит WiS имеет концентрацию до 31 м (9 м NaOTf – 22 м TEAOTf) и окно электрохимической стабилизации до 3,3 В (рис. 8a). A Na 1,88 Mn [Fe (CN) 6 ] 0,97 · 1,35H 2 O // IC-WiS на основе Na // NaTiOPO 4 Полная батарея с высоким напряжением отсечки (2,5 В) и Установлена высокая плотность энергии 71 Втч кг -1 , которая показала выдающуюся стабильность при циклическом изменении как на низких, так и на высоких скоростях (рис. 8b – e).
a Окно электрохимической стабильности 9 моль кг −1 Электролиты NaOTf и электролиты Na IC-WiS (9 м NaOTf + 22 м TEAOTf) при скорости сканирования 10 мВ с −1 , в которой Ti и Al используются как положительный и отрицательный коллекторы соответственно. b Кривые заряда-разряда первого цикла для положительных электродов NaMnHCF (1 C) и отрицательных электродов NaTiOPO 4 (0,2 C) в электролитах 9 m NaOTf и 9 m NaOTf + 22 mTEAOTf, соответственно. c CV-кривые отрицательных электродов NaTiOPO 4 и положительных электродов NaMnHCF при 1 мВ с -1 в 22 м TEAOTf и 9 м NaOTf + 22 м TEAOTf, соответственно. d Зарядно-разрядные кривые NaMnHCF // NaTiOPO 4 аккумуляторов в первом, четвертом и десятом циклах. e Циклические характеристики батареи NaMnHCF // NaTiOPO 4 при 1 ° C [55]. Воспроизведено с разрешения Ref. [55]. Copyright 2019, Wiley – VCH
c CV-кривые отрицательных электродов NaTiOPO 4 и положительных электродов NaMnHCF при 1 мВ с -1 в 22 м TEAOTf и 9 м NaOTf + 22 м TEAOTf, соответственно. d Зарядно-разрядные кривые NaMnHCF // NaTiOPO 4 аккумуляторов в первом, четвертом и десятом циклах. e Циклические характеристики батареи NaMnHCF // NaTiOPO 4 при 1 ° C [55]. Воспроизведено с разрешения Ref. [55]. Copyright 2019, Wiley – VCH
Теоретические расчеты показали, что нанесение пленки Al 2 O 3 на Al или пленки TiO 2 на Ti может увеличить энергетический барьер расщепления воды (рис.9а) [56]. При толщине примерно 3 нм и 5 нм соответственно для пленок Al 2 O 3 и TiO 2 окно электрохимической стабильности расширяется до 3,5 В, когда металлы, покрытые этими оксидными пленками, используются в качестве коллекторы и 15 м водный раствор NaClO 4 используется в качестве электролита (рис.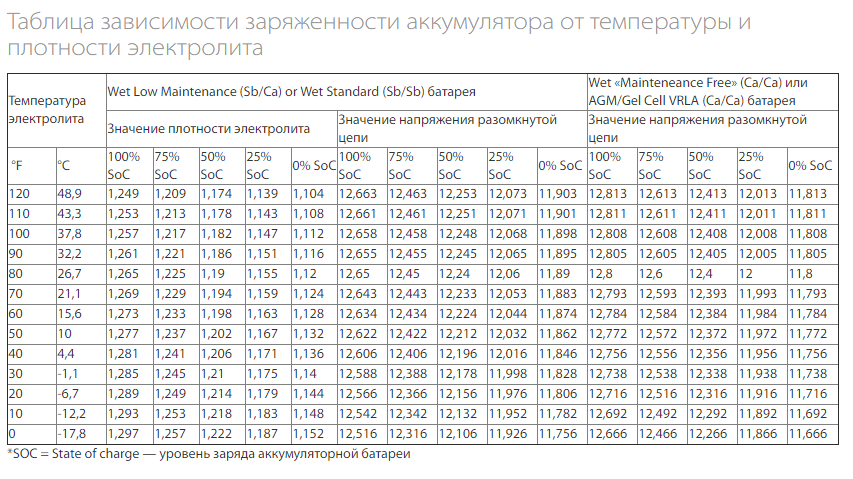 13б). Кроме того, в концентрированных электролитах (15 м NaClO 4 ) на поверхностях TiS 2 образуется плотная межфазная фаза электрод – электролит.Таким образом, TiS 2 , обладающий низким реакционным потенциалом, был впервые продемонстрирован в качестве материала отрицательного электрода в водной батарее (рис. 9c). Полученный в результате ASIB с использованием TiS 2 в качестве отрицательного электрода и MFCN (гексацианоферрат натрия марганца) в качестве положительного электрода обеспечивает плотность энергии 100 Вт · ч кг -1 при напряжении холостого хода (OCV) до 2,6 В и составляет работал с почти 100% кулоновской эффективностью до 1000 циклов (рис. 9d).
13б). Кроме того, в концентрированных электролитах (15 м NaClO 4 ) на поверхностях TiS 2 образуется плотная межфазная фаза электрод – электролит.Таким образом, TiS 2 , обладающий низким реакционным потенциалом, был впервые продемонстрирован в качестве материала отрицательного электрода в водной батарее (рис. 9c). Полученный в результате ASIB с использованием TiS 2 в качестве отрицательного электрода и MFCN (гексацианоферрат натрия марганца) в качестве положительного электрода обеспечивает плотность энергии 100 Вт · ч кг -1 при напряжении холостого хода (OCV) до 2,6 В и составляет работал с почти 100% кулоновской эффективностью до 1000 циклов (рис. 9d).
a Окно электрохимической стабильности 15 м NaClO 4 водный раствор, когда используются Pt, Ti, Al, покрытые Al 2 O 3 разной толщины и Ti, покрытый TiO 2 разной толщины как токоприемники. b Энергия адсорбции O * и HO * на поверхности Ti или TiO 2 и H 2 O * и H * на поверхности Al или Al 2 O 3 соответственно. c Кривая CV для отрицательных электродов TiS 2 при использовании алюминиевой фольги с регулируемым временем термообработки в качестве токоприемников. d Циклические характеристики батарей TiS 2 / MFCN при 5 ° C [56]. Воспроизведено с разрешения Ref. [56]. Copyright 2019, Elsevier BV
b Энергия адсорбции O * и HO * на поверхности Ti или TiO 2 и H 2 O * и H * на поверхности Al или Al 2 O 3 соответственно. c Кривая CV для отрицательных электродов TiS 2 при использовании алюминиевой фольги с регулируемым временем термообработки в качестве токоприемников. d Циклические характеристики батарей TiS 2 / MFCN при 5 ° C [56]. Воспроизведено с разрешения Ref. [56]. Copyright 2019, Elsevier BV
Zn – Na Hybrid Batteries
Поскольку натриевые соли дешевле солей лития, водные Zn – Na гибридные ионные аккумуляторы представляют собой очень многообещающую перспективу для замены водных Zn – Li гибридных аккумуляторов и стали привлекательными устойчивое устройство хранения энергии. Первый водный гибридный ионный аккумулятор Zn – Na был зарегистрирован нашей группой и состоял из стержнеобразного Na 0.95 MnO 2 материал положительного электрода и металлический отрицательный электрод из цинка, которые показали среднее напряжение разряда 1,4 В и плотность энергии до 78 Вт · ч кг −1 (рис.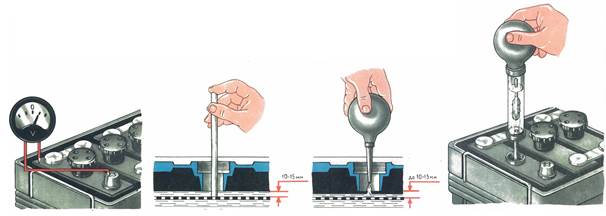 10a, b) [57].
10a, b) [57].
a CV-кривые Zn и Na 0,95 MnO 2 в 0,5 M Zn (CH 3 COO) 2 + 0,5 M CH 3 Водный раствор COONa (0,5 мВ с −1 ). b Цикличность цинка // Na 0.95 MnO 2 ASIB при скорости 4 ° C [56]. Воспроизведено с разрешения Ref. [57]. Авторское право 2014 г., Королевское химическое общество. c CV-кривая Na 2 MnFe (CN) 6 положительных электродов в электролитах с добавлением SDS (5 мВ с −1 ). d Кривые заряда / разряда Na 2 MnFe (CN) 6 положительных электродов в электролитах с добавлением SDS (0,5 C) [59]. Воспроизведено с разрешения Ref. [59]. Copyright 2017, Королевское химическое общество
Na + -ионный суперионный проводник (NASICON) -структурированный Na 3 V 2 (PO 4 ) 3 (NVP) с высокой теоретической емкостью 118 мАч g -1 стал новым потенциальным кандидатом в качестве положительного электрода для водных Na-Zn гибридных батарей. Гибридная батарея Zn-NVP может обеспечивать удельную энергию 67 Вт · ч · кг −1 . Однако емкость Na 3 V 2 (PO 4 ) 3 в Zn-Na гибридных водных перезаряжаемых батареях остается серьезной проблемой. Помимо материалов положительного электрода NVP / C, другие полианионные соединения [такие как покрытый углеродом Na 3 V 2 (PO 4 ) 2 F 3 ] были рассмотрены в качестве положительных электродов для дальнейшего улучшения напряжение водных гибридных аккумуляторов Na – Zn [58].Гибридный Zn – Na 3 В 2 O 2 x (PO 4 ) 2 F 3−2 x батарея обладает высоким выходным напряжением 1,7 В и высокой энергией. плотность 84 Втч кг −1 .
Гибридная батарея Zn-NVP может обеспечивать удельную энергию 67 Вт · ч · кг −1 . Однако емкость Na 3 V 2 (PO 4 ) 3 в Zn-Na гибридных водных перезаряжаемых батареях остается серьезной проблемой. Помимо материалов положительного электрода NVP / C, другие полианионные соединения [такие как покрытый углеродом Na 3 V 2 (PO 4 ) 2 F 3 ] были рассмотрены в качестве положительных электродов для дальнейшего улучшения напряжение водных гибридных аккумуляторов Na – Zn [58].Гибридный Zn – Na 3 В 2 O 2 x (PO 4 ) 2 F 3−2 x батарея обладает высоким выходным напряжением 1,7 В и высокой энергией. плотность 84 Втч кг −1 .
берлинская лазурь и ее аналоги являются наиболее привлекательными материалами для гибридных аккумуляторов на водной основе из-за их большого канала и открытой каркасной структуры, которая способствует быстрой диффузии ионов.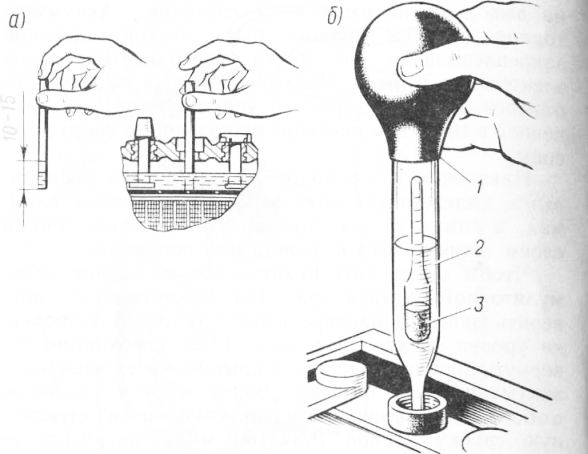 Рабочее напряжение гибридных Na-Zn-аккумуляторов на водной основе высокое, и на срок службы аккумулятора сильно влияет побочная реакция выделения водорода или выделения кислорода.Было обнаружено, что окно электрохимической стабильности электролита может быть увеличено с 1,8 до 2,55 В путем добавления поверхностно-активных веществ в смешанный электролит (рис. 10а, б) [59]. Путем моделирования теории функционала плотности было обнаружено, что энергетический барьер молекул воды, проходящих через адсорбционный слой SDS, выше, чем барьер ионов натрия, проходящих через адсорбционный слой SDS. Ионы натрия легче проходят через гидрофобный слой, чем молекулы воды, тем самым препятствуя разложению воды, улучшая таким образом окно электрохимической стабильности электролита.На основе этого электролита была успешно собрана водная перезаряжаемая ионно-цинковая аккумуляторная батарея с нанокубами Na 2 MnFe (CN) 6 в качестве катодов и листами цинка в качестве отрицательных электродов.
Рабочее напряжение гибридных Na-Zn-аккумуляторов на водной основе высокое, и на срок службы аккумулятора сильно влияет побочная реакция выделения водорода или выделения кислорода.Было обнаружено, что окно электрохимической стабильности электролита может быть увеличено с 1,8 до 2,55 В путем добавления поверхностно-активных веществ в смешанный электролит (рис. 10а, б) [59]. Путем моделирования теории функционала плотности было обнаружено, что энергетический барьер молекул воды, проходящих через адсорбционный слой SDS, выше, чем барьер ионов натрия, проходящих через адсорбционный слой SDS. Ионы натрия легче проходят через гидрофобный слой, чем молекулы воды, тем самым препятствуя разложению воды, улучшая таким образом окно электрохимической стабильности электролита.На основе этого электролита была успешно собрана водная перезаряжаемая ионно-цинковая аккумуляторная батарея с нанокубами Na 2 MnFe (CN) 6 в качестве катодов и листами цинка в качестве отрицательных электродов.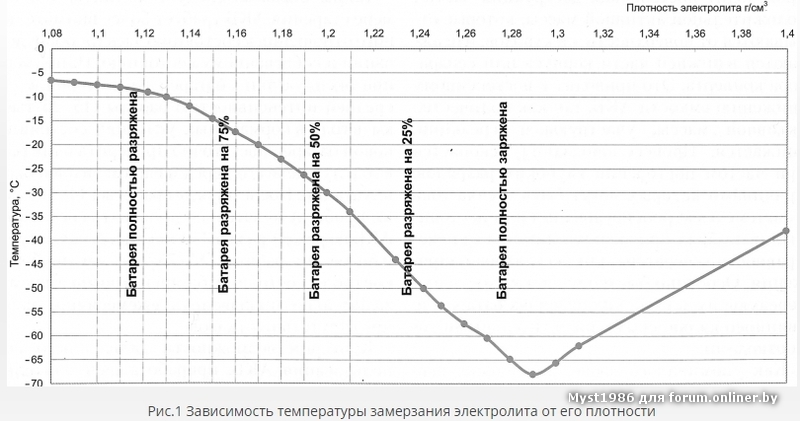 Аккумулятор имеет рабочее напряжение до 2 В и высокую плотность энергии 170 Втч кг -1 (рис. 10c, d). Стратегия проектирования улучшения окна электрохимической стабильности электролитов за счет добавления добавок обеспечивает эффективность, близкую к эффективности электролитов WiS, и низкую стоимость.Он обеспечивает новое понимание для дальнейшего развития недорогих и высоковольтных батарей на водном растворе.
Аккумулятор имеет рабочее напряжение до 2 В и высокую плотность энергии 170 Втч кг -1 (рис. 10c, d). Стратегия проектирования улучшения окна электрохимической стабильности электролитов за счет добавления добавок обеспечивает эффективность, близкую к эффективности электролитов WiS, и низкую стоимость.Он обеспечивает новое понимание для дальнейшего развития недорогих и высоковольтных батарей на водном растворе.
Водные K-ионные батареи (AKIB)
Высокий потенциал ионизации и большой ионный радиус (0,138 нм) K являются основными причинами ограниченного развития высокоэффективных электродных материалов AKIB. На сегодняшний день наиболее перспективными материалами положительных электродов для AKIB являются аналоги берлинской голубой (PBA).
Среди различных материалов положительных электродов PBA имеет широкую перспективу применения благодаря своей стабильности в воде, простоте приготовления и отличным электрохимическим характеристикам.Сообщается о разнообразных положительных электродах из ПБА в AKIB, но лишь немногие материалы обладают полностью удовлетворительными свойствами. Из-за отсутствия материалов-кандидатов с подходящими окислительно-восстановительными потенциалами, несколько многообещающих материалов были описаны в качестве материала отрицательного электрода AKIB. Ранее сообщалось, что электролит WiS на основе ацетата калия имеет широкий диапазон электрохимической стабильности, но pH электролита является слабощелочным (pH = 9), что не подходит для материалов положительных электродов.Поэтому очень важно изучить новый тип электродов с лучшей совместимостью с электролитом WiS на основе K + . В целом, из-за ограничений электродов и электролитов сообщений о разнообразии AKIB немного. Недавно был изготовлен полный AKIB, который состоял из Fe-замещенного Mn-богатого PBA {K x Fe y Mn 1- y [Fe (CN) 6 ] w · z H 2 O} положительный электрод, отрицательный электрод из органического 3,4,9,10-перилентетракарбоновой диимида (PTCDI) и 22 м KCF 3 SO 3 WiS электролит [60].
Из-за отсутствия материалов-кандидатов с подходящими окислительно-восстановительными потенциалами, несколько многообещающих материалов были описаны в качестве материала отрицательного электрода AKIB. Ранее сообщалось, что электролит WiS на основе ацетата калия имеет широкий диапазон электрохимической стабильности, но pH электролита является слабощелочным (pH = 9), что не подходит для материалов положительных электродов.Поэтому очень важно изучить новый тип электродов с лучшей совместимостью с электролитом WiS на основе K + . В целом, из-за ограничений электродов и электролитов сообщений о разнообразии AKIB немного. Недавно был изготовлен полный AKIB, который состоял из Fe-замещенного Mn-богатого PBA {K x Fe y Mn 1- y [Fe (CN) 6 ] w · z H 2 O} положительный электрод, отрицательный электрод из органического 3,4,9,10-перилентетракарбоновой диимида (PTCDI) и 22 м KCF 3 SO 3 WiS электролит [60]. 22-метровый электролит KCF 3 SO 3 WiS имеет широкий диапазон напряжений 3 В, который не только препятствует растворению как положительных, так и отрицательных электродов во время цикла, обеспечивая хорошую стабильность цикла полной батареи, но также позволяет полная батарея должна работать при напряжении выше 2 В при низком значении 0,1 C (рис. 11a). Кроме того, как положительный, так и отрицательный электроды обладают высокой емкостью, высокими характеристиками и хорошей стабильностью при переключении. Таким образом, полная батарея обеспечивает высокую плотность энергии 80 Вт · ч · кг −1 и отличную стабильность при циклических нагрузках с сохранением емкости 73% за 2000 циклов при 4 ° C (рис.11б). Несмотря на то, что эта аккумуляторная система имеет много преимуществ, есть еще много областей, требующих дальнейшего улучшения для содействия ее практическому применению. Прежде всего, что касается электродных материалов, хотя Fe является лучшим выбором для замены положительного электрода PBA, богатого Mn, материалы отрицательного электрода должны быть оптимизированы с высокой емкостью и низким окислительно-восстановительным потенциалом для дальнейшего увеличения плотности энергии AKIB.
22-метровый электролит KCF 3 SO 3 WiS имеет широкий диапазон напряжений 3 В, который не только препятствует растворению как положительных, так и отрицательных электродов во время цикла, обеспечивая хорошую стабильность цикла полной батареи, но также позволяет полная батарея должна работать при напряжении выше 2 В при низком значении 0,1 C (рис. 11a). Кроме того, как положительный, так и отрицательный электроды обладают высокой емкостью, высокими характеристиками и хорошей стабильностью при переключении. Таким образом, полная батарея обеспечивает высокую плотность энергии 80 Вт · ч · кг −1 и отличную стабильность при циклических нагрузках с сохранением емкости 73% за 2000 циклов при 4 ° C (рис.11б). Несмотря на то, что эта аккумуляторная система имеет много преимуществ, есть еще много областей, требующих дальнейшего улучшения для содействия ее практическому применению. Прежде всего, что касается электродных материалов, хотя Fe является лучшим выбором для замены положительного электрода PBA, богатого Mn, материалы отрицательного электрода должны быть оптимизированы с высокой емкостью и низким окислительно-восстановительным потенциалом для дальнейшего увеличения плотности энергии AKIB. Кроме того, чтобы снизить стоимость всей батареи и в то же время для обеспечения ее превосходных мощных характеристик и высокого рабочего напряжения, следует изучить менее дорогие соли с высокой растворимостью, такие как снижение концентрации электролита путем изменения границы раздела и использования смешанные вода / неводные растворители.
Кроме того, чтобы снизить стоимость всей батареи и в то же время для обеспечения ее превосходных мощных характеристик и высокого рабочего напряжения, следует изучить менее дорогие соли с высокой растворимостью, такие как снижение концентрации электролита путем изменения границы раздела и использования смешанные вода / неводные растворители.
a Окно электрохимической стабильности 1 м и 22 м KCF 3 SO 3 электролитов при скорости сканирования 10 мВ с -1 при использовании Ti-сетки в качестве токосъемника. b Циклические характеристики PTCDI / K x Fe y Mn 1- y [Fe (CN) 6 ] w · z H 2 O полные ячейки при 4 ° C. Воспроизведено с разрешения Ref.{+} \) ионный аккумулятор был описан Ву и его коллегами в 2017 году с (NH 4 ) 1,47 Ni [Fe (CN) 6 ] 0,88 в качестве положительного электрода и PTCDI (3,4 , 9,10-перилентетракарбоновый диимид) в качестве отрицательного электрода (рис. 12) [61]. Эта батарея имела среднее рабочее напряжение всего 1,0 В и низкую плотность энергии 43 Вт · ч кг -1 . Водно-аммониевый двухионный аккумулятор с максимальным рабочим напряжением 1,9 В и высокой плотностью энергии 51,3 Вт · ч. Кг -1 был построен с использованием электродов из органического полимера [62].{+} \) положительные электроды имеют более высокий окислительно-восстановительный потенциал.
12) [61]. Эта батарея имела среднее рабочее напряжение всего 1,0 В и низкую плотность энергии 43 Вт · ч кг -1 . Водно-аммониевый двухионный аккумулятор с максимальным рабочим напряжением 1,9 В и высокой плотностью энергии 51,3 Вт · ч. Кг -1 был построен с использованием электродов из органического полимера [62].{+} \) положительные электроды имеют более высокий окислительно-восстановительный потенциал.
a Принципиальная схема работы водных ионных аккумуляторов NH 4 + на основе положительных электродов Prussian White и отрицательных электродов PTCDI. b Зарядно-разрядные кривые водной NH 4 + -ионной батареи в первом, втором, пятом и десятом циклах (60 мА g −1 ). c Производительность при езде на велосипеде при скорости 3 C [61].Воспроизведено с разрешения Ref. [61]. Авторское право 2017, Wiley – VCH. d Окно электрохимической стабильности 1 M и 25 m AmAc электролитов (1 мВ с −1 ). e Циклические характеристики TiO 1,85 (OH) 0,30 · 0,28H 2 O-электрод в 25 м AmAc (1 A g −1 ) [63]. Воспроизведено с разрешения Ref. [63]. Авторские права 2017, Wiley – VCH. (е) ЦВА электродов из Zn и Na-FeHCF в водном растворе 1 M (NH 4 ) 2 SO 4 + 20 мМ ZnSO 4 при скорости сканирования 3 мВ с −1 . г Кривые заряда-разряда гибридных Zn / Na-FeHCF аккумуляторов. Воспроизведено с разрешения Ref. [64]. Авторское право 2019, John Wiley and Sons. ч Кривые заряда – разряда при различных плотностях тока и циклические характеристики и гибридных аккумуляторов Zn / CuHCF при плотности тока 1800 мА г –1 . Воспроизведено с разрешения Ref. [65]. Авторское право 2019 г., Американское химическое общество
e Циклические характеристики TiO 1,85 (OH) 0,30 · 0,28H 2 O-электрод в 25 м AmAc (1 A g −1 ) [63]. Воспроизведено с разрешения Ref. [63]. Авторские права 2017, Wiley – VCH. (е) ЦВА электродов из Zn и Na-FeHCF в водном растворе 1 M (NH 4 ) 2 SO 4 + 20 мМ ZnSO 4 при скорости сканирования 3 мВ с −1 . г Кривые заряда-разряда гибридных Zn / Na-FeHCF аккумуляторов. Воспроизведено с разрешения Ref. [64]. Авторское право 2019, John Wiley and Sons. ч Кривые заряда – разряда при различных плотностях тока и циклические характеристики и гибридных аккумуляторов Zn / CuHCF при плотности тока 1800 мА г –1 . Воспроизведено с разрешения Ref. [65]. Авторское право 2019 г., Американское химическое общество
Как и в случае с ARLB, электролиты WiS можно использовать для расширения диапазона напряжений.Недавно новый электролит WiS (25 m CH 3 COONH 4 ) был использован в AAIB, который имеет окно потенциала 2,95 В (рис. {+} \) также является эффективным способом увеличения плотности энергии AAIB [64, 65].Наша группа была первой, кто сообщил о водной перезаряжаемой гибридной аммонийно-цинковой батарее (ARAHB), содержащей высокопрочный гексацианоферрат натрия и железа NaFe III Fe II (CN) 6 (Na-FeHCF) положительный электрод нанокуба и низко- недорогой цинковый отрицательный электрод, с рабочим напряжением 1,3 В и высокой плотностью энергии 81,7 Вт · ч. кг −1 (в расчете на общую массу активных материалов) (рис. 12f, g). Затем мы дополнительно увеличили плотность энергии ARAHB до 114 Вт · ч · кг -1 , используя наночастицы CuHCF в качестве материала положительного электрода (рис.12h, i).
{+} \) также является эффективным способом увеличения плотности энергии AAIB [64, 65].Наша группа была первой, кто сообщил о водной перезаряжаемой гибридной аммонийно-цинковой батарее (ARAHB), содержащей высокопрочный гексацианоферрат натрия и железа NaFe III Fe II (CN) 6 (Na-FeHCF) положительный электрод нанокуба и низко- недорогой цинковый отрицательный электрод, с рабочим напряжением 1,3 В и высокой плотностью энергии 81,7 Вт · ч. кг −1 (в расчете на общую массу активных материалов) (рис. 12f, g). Затем мы дополнительно увеличили плотность энергии ARAHB до 114 Вт · ч · кг -1 , используя наночастицы CuHCF в качестве материала положительного электрода (рис.12h, i).
Водные цинково-ионные батареи (AZIB)
Цинк является наиболее идеальным материалом для отрицательных электродов для водных аккумуляторов из-за его низкого окислительно-восстановительного потенциала (- 0,76 В по сравнению с SHE) и высокой удельной емкости (820 мАч г -1 ) , богатые запасы и нетоксичные свойства. Он широко используется в качестве отрицательных электродов в щелочных батареях на основе цинка (таких как щелочные цинк-MnO 2 батареи [66], цинк-никелевые батареи [67, 68] и Zn // Co 3 O 4 батареи [69, 70], воздушно-цинковые батареи [71, 72], ионно-цинковые батареи и гибридные цинковые батареи.В последнее время было много обзоров по этим аспектам, поэтому мы не будем подробно останавливаться на них с точки зрения электродных материалов [73,74,75,76,77,78,79,80,81,82,83,84,85 , 86]. Здесь мы суммируем недавний прогресс в области цинковых батарей с высоким напряжением и высокой плотностью энергии. В Таблице 3 и на Рис. 13 представлены подробные данные о показателях работы АЗИБ на сегодняшний день.
Он широко используется в качестве отрицательных электродов в щелочных батареях на основе цинка (таких как щелочные цинк-MnO 2 батареи [66], цинк-никелевые батареи [67, 68] и Zn // Co 3 O 4 батареи [69, 70], воздушно-цинковые батареи [71, 72], ионно-цинковые батареи и гибридные цинковые батареи.В последнее время было много обзоров по этим аспектам, поэтому мы не будем подробно останавливаться на них с точки зрения электродных материалов [73,74,75,76,77,78,79,80,81,82,83,84,85 , 86]. Здесь мы суммируем недавний прогресс в области цинковых батарей с высоким напряжением и высокой плотностью энергии. В Таблице 3 и на Рис. 13 представлены подробные данные о показателях работы АЗИБ на сегодняшний день.
Плотность энергии и средняя разрядная емкость различных AZIB, AMIB, ACIB и AAIB с высоким напряжением и плотностью энергии
Zn – MnO 2 Батареи на основе водных электролитов на основе слабой соли цинка в настоящее время являются важной темой исследований [87, 88,89].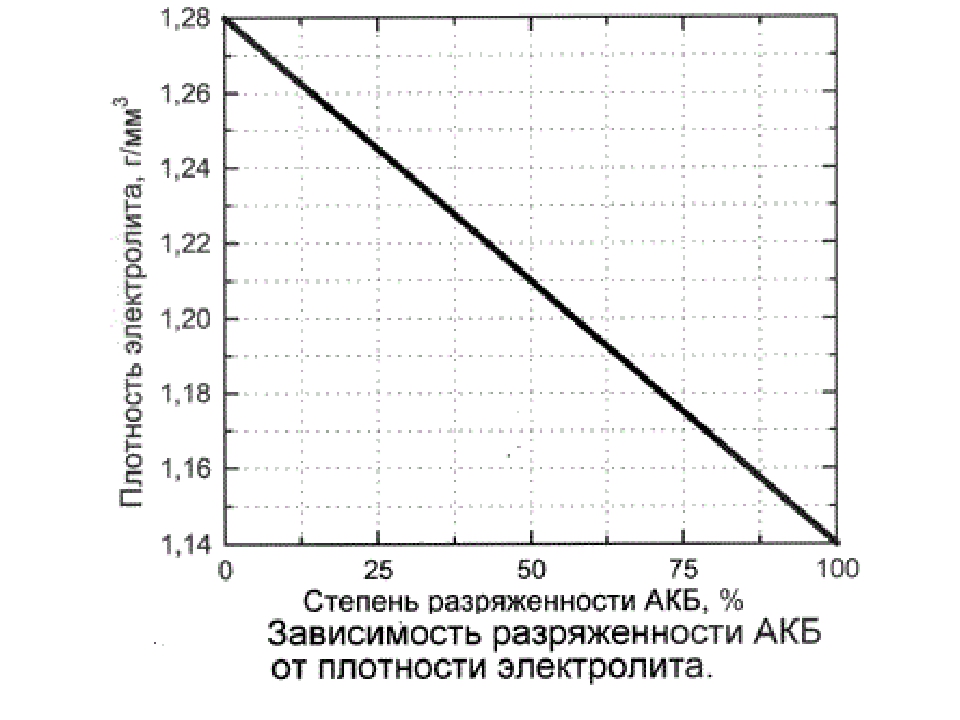 Несмотря на значительный прогресс, механизм реакции хранения Zn 2+ в материалах на основе Mn остается спорным. Предыдущий обзор суммировал три механизма накопления заряда [73]: (а) обратимое введение / извлечение ионов Zn в объемных материалах; (б) обратимые протонные реакции, сопровождающиеся отложением сульфата гидроксида цинка; и (c) H + и Zn 2+ , последовательно внедряемые / удаляемые на разных стадиях заряда-разряда.На основе этих механизмов (рис. 14a) батарея Zn – MnO 2 использует только емкость и напряжение, обеспечиваемые окислительно-восстановительной реакцией пары Mn 4+ / Mn 3+ , ограничивая емкость батареи и выходную мощность. Напряжение. Это выдвигает новые требования к электрохимии цинка и марганца. Поскольку ион Mn поливалентен (+2, +3 и +4), двухэлектронная реакция Mn 4+ / Mn 2+ емкостью 616 мА г −1 и платформа более высокого напряжения можно постулировать.Недавно был предложен новый механизм, который включает обратимое осаждение / растворение Mn 2+ / MnO 2 , химическое превращение (между MnO 2 и MnOOH) и введение Zn 2+ [90].
Несмотря на значительный прогресс, механизм реакции хранения Zn 2+ в материалах на основе Mn остается спорным. Предыдущий обзор суммировал три механизма накопления заряда [73]: (а) обратимое введение / извлечение ионов Zn в объемных материалах; (б) обратимые протонные реакции, сопровождающиеся отложением сульфата гидроксида цинка; и (c) H + и Zn 2+ , последовательно внедряемые / удаляемые на разных стадиях заряда-разряда.На основе этих механизмов (рис. 14a) батарея Zn – MnO 2 использует только емкость и напряжение, обеспечиваемые окислительно-восстановительной реакцией пары Mn 4+ / Mn 3+ , ограничивая емкость батареи и выходную мощность. Напряжение. Это выдвигает новые требования к электрохимии цинка и марганца. Поскольку ион Mn поливалентен (+2, +3 и +4), двухэлектронная реакция Mn 4+ / Mn 2+ емкостью 616 мА г −1 и платформа более высокого напряжения можно постулировать.Недавно был предложен новый механизм, который включает обратимое осаждение / растворение Mn 2+ / MnO 2 , химическое превращение (между MnO 2 и MnOOH) и введение Zn 2+ [90].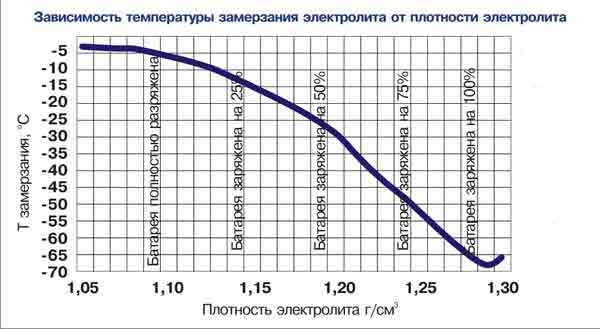 На основе уникальной двухэлектронной окислительно-восстановительной реакции Mn 4+ / Mn 2+ была собрана высоковольтная электролитическая цинково-марганцевая батарея с высоким разрядным плато 1,95 В и высокой плотностью энергии 409 Вт · ч · кг. −1 , а также отличные характеристики при циклировании (сохранение емкости 92% после 1800 циклов) (рис.14б, в).
На основе уникальной двухэлектронной окислительно-восстановительной реакции Mn 4+ / Mn 2+ была собрана высоковольтная электролитическая цинково-марганцевая батарея с высоким разрядным плато 1,95 В и высокой плотностью энергии 409 Вт · ч · кг. −1 , а также отличные характеристики при циклировании (сохранение емкости 92% после 1800 циклов) (рис.14б, в).
a Схема трехступенчатых процессов гальваностатического разряда. b Кривые гальваностатического разряда. c Циклические характеристики при 30 мА см −2 . Электролитические ячейки Zn – MnO 2 заряжаются при постоянном напряжении 2,2 В (по сравнению с Zn / Zn 2+ ) [91]. Воспроизведено с разрешения Ref. [91]. Copyright 2017, Американское химическое общество)
Для дальнейшего увеличения напряжения и плотности энергии Zn-MnO 2 батареи, мы можем использовать гибридный электролит с разными значениями pH, например щелочно-нейтральный электролит и щелочно-кислотный электролит. Недавно наша группа сообщила о Zn // MnO 2 батарее с щелочным (1 M NaOH и 0,01 M Zn (Ac) 2 ) -нейтральным (2 M ZnSO 4 + 0,1 M MnSO 4 ) гибридом. электролит и мембрана Na + -Nafion от DKJ Co. Ltd. Принцип ее работы показан на рис. 15а. Использование Zn / Zn (OH) 2− 4 отрицательный электрод в щелочном растворе, который имеет относительно низкий окислительно-восстановительный потенциал, напряжение аккумулятора значительно увеличивается.Аккумулятор в сборе имеет среднее плато разрядного напряжения 1,7 В и удельную энергию 487 Вт · ч · кг −1 [92]. Кроме того, за счет объединения двух окислительно-восстановительных реакций электрода растворения / осаждения MnO 2 / Mn 2+ и Zn / Zn (OH) 2− 4 с использованием двойных кислотно-щелочных электролитов и ионоселективной мембраны была сконструирована высокоэнергетическая батарея Zn-MnO 2 [93].
Недавно наша группа сообщила о Zn // MnO 2 батарее с щелочным (1 M NaOH и 0,01 M Zn (Ac) 2 ) -нейтральным (2 M ZnSO 4 + 0,1 M MnSO 4 ) гибридом. электролит и мембрана Na + -Nafion от DKJ Co. Ltd. Принцип ее работы показан на рис. 15а. Использование Zn / Zn (OH) 2− 4 отрицательный электрод в щелочном растворе, который имеет относительно низкий окислительно-восстановительный потенциал, напряжение аккумулятора значительно увеличивается.Аккумулятор в сборе имеет среднее плато разрядного напряжения 1,7 В и удельную энергию 487 Вт · ч · кг −1 [92]. Кроме того, за счет объединения двух окислительно-восстановительных реакций электрода растворения / осаждения MnO 2 / Mn 2+ и Zn / Zn (OH) 2− 4 с использованием двойных кислотно-щелочных электролитов и ионоселективной мембраны была сконструирована высокоэнергетическая батарея Zn-MnO 2 [93]. Рабочий механизм показан на рис. 15б.При зарядке Zn (OH) 2− 4 восстанавливается до Zn, а Mn 2+ окисляется до MnO 2 . В то же время катионы (K + ) и анионы (SO 4 2-), хранящиеся в BPM, возвращаются на положительный и отрицательный электроды соответственно, достигая баланса заряда. В процессе разряда эти два процесса развиваются в противоположном направлении. Батарея Zn – Mn 2+ имела высокое рабочее напряжение 2,44 В и высокий кулоновский КПД 98.4% и сохранение разрядной емкости 97,5% после 1500 циклов. В частности, его удельная энергия чрезвычайно высока (≈ 1503 Вт · ч · кг -1 , рассчитано на основе материала положительного электрода), что является самым высоким показателем среди всех водных аккумуляторов на основе цинка, о которых сообщалось до сих пор, и даже сравнимо с таковыми из Zn- воздушные батареи.
Рабочий механизм показан на рис. 15б.При зарядке Zn (OH) 2− 4 восстанавливается до Zn, а Mn 2+ окисляется до MnO 2 . В то же время катионы (K + ) и анионы (SO 4 2-), хранящиеся в BPM, возвращаются на положительный и отрицательный электроды соответственно, достигая баланса заряда. В процессе разряда эти два процесса развиваются в противоположном направлении. Батарея Zn – Mn 2+ имела высокое рабочее напряжение 2,44 В и высокий кулоновский КПД 98.4% и сохранение разрядной емкости 97,5% после 1500 циклов. В частности, его удельная энергия чрезвычайно высока (≈ 1503 Вт · ч · кг -1 , рассчитано на основе материала положительного электрода), что является самым высоким показателем среди всех водных аккумуляторов на основе цинка, о которых сообщалось до сих пор, и даже сравнимо с таковыми из Zn- воздушные батареи.
a Принципиальная схема разработанной водной цинково-марганцевой батареи [92]. Воспроизведено с разрешения [92]. Авторское право 2020, Американское химическое общество. b Принципиальная схема и механизм Zn – MnO 2 батареи, использующей кислотно-щелочной двойной электролит в условиях заряда и разряда. [93] Воспроизведено с разрешения Ref. [93]. Copyright 2020, Wiley – VCH
Воспроизведено с разрешения [92]. Авторское право 2020, Американское химическое общество. b Принципиальная схема и механизм Zn – MnO 2 батареи, использующей кислотно-щелочной двойной электролит в условиях заряда и разряда. [93] Воспроизведено с разрешения Ref. [93]. Copyright 2020, Wiley – VCH
PBA имеют трехмерный открытый каркас и большую щелевую структуру и считаются обратимыми Zn 2+ материалами-хозяевами интеркаляции / деинтеркаляции с быстрой зарядкой и разрядкой, высоким рабочим потенциалом и идеальным электрохимические свойства.В материалах электродов PBA обычно только один ион переходного металла (в большинстве случаев железа) считается электрохимически активным в системе водного электролита, что приводит к его ограниченной удельной емкости в водном растворе Zn 2+ (≈ 60 мАч г −1 ), тогда как в большинстве случаев напряжение низкое (~ 1,2 В Zn / Zn 2+ ) и, следовательно, удельная энергия батареи мала. Недавно был разработан новый вид кубиков Co / Fe PBA (гексацианоферрат кобальта, CoFe (CN) 6 ), в которых ожидается, что ионы Co и Fe будут эффективно участвовать в процессе двухэлектронного накопления энергии, что приведет к усилению удельной емкости [94].Как проиллюстрировано на фиг. 16a, вакансии, образованные в результате извлечения ионов K из каркаса CoFe (CN) 6 , имеют тенденцию отдавать предпочтение интеркаляции Zn 2+ . Интеркаляция / деинтеркаляция Zn 2+ требует двух стадий из-за разной энергии активации активных пар Co (III) / Co (II) и Fe (III) / Fe (II), что подтверждается кривыми CV (рис. . 16b). Собранная батарея Zn / CoFe (CN) 6 не только имела отличную скорость и циклические характеристики, но также работала на плато 1.75 В (рис. 16c) и показала плотность энергии 250 Вт · ч · кг −1 .
Недавно был разработан новый вид кубиков Co / Fe PBA (гексацианоферрат кобальта, CoFe (CN) 6 ), в которых ожидается, что ионы Co и Fe будут эффективно участвовать в процессе двухэлектронного накопления энергии, что приведет к усилению удельной емкости [94].Как проиллюстрировано на фиг. 16a, вакансии, образованные в результате извлечения ионов K из каркаса CoFe (CN) 6 , имеют тенденцию отдавать предпочтение интеркаляции Zn 2+ . Интеркаляция / деинтеркаляция Zn 2+ требует двух стадий из-за разной энергии активации активных пар Co (III) / Co (II) и Fe (III) / Fe (II), что подтверждается кривыми CV (рис. . 16b). Собранная батарея Zn / CoFe (CN) 6 не только имела отличную скорость и циклические характеристики, но также работала на плато 1.75 В (рис. 16c) и показала плотность энергии 250 Вт · ч · кг −1 .
a Принципиальная схема обратимой интеркаляции / деинтеркаляции Zn 2+ в каркасе CoFe (CN) 6 во время процессов зарядки и разрядки. b Первые три цикла кривых CV (1 мВ с −1 ). c Кривые постоянного тока заряда-разряда при различных плотностях тока [94]. Воспроизведено с разрешения Ref. [94]. Авторское право 2019, Wiley – VCH. d Принципиальная диаграмма взаимосвязи между энергией и плотностью состояний (DOS) в Co 0,247 V 2 O 5 · 0,944H 2 O и V 2 O 5 · n H 2 O положительные электроды. Воспроизведено с разрешения Ref. [102]. Copyright 2019, Wiley – VCH
b Первые три цикла кривых CV (1 мВ с −1 ). c Кривые постоянного тока заряда-разряда при различных плотностях тока [94]. Воспроизведено с разрешения Ref. [94]. Авторское право 2019, Wiley – VCH. d Принципиальная диаграмма взаимосвязи между энергией и плотностью состояний (DOS) в Co 0,247 V 2 O 5 · 0,944H 2 O и V 2 O 5 · n H 2 O положительные электроды. Воспроизведено с разрешения Ref. [102]. Copyright 2019, Wiley – VCH
Оксиды на основе ванадия, которые обладают несколькими степенями окисления и высокой емкостью (> 300 мАч g −1 ), широко используются в качестве материалов положительных электродов для водных цинк-ионных батарей.Существуют различные оксиды на основе ванадия, которые обеспечивают значительную емкость и отличную циклическую стабильность, которые интенсивно изучаются, такие как V 2 O 5 · n H 2 O [95], NaV 3 O 8 · 1,5H 2 O [96], Ca 0,24 V 2 O 5 · 0,83H 2 O [97], H 2 V 3 O 8 [98, 99], K 2 V 6 O 16 · 2. 7H 2 O [100] и ванадат алюминия [101].Однако неприятным аспектом является то, что 80% их емкости находится ниже 1,0 В, что приводит к низкой плотности энергии (<250 Вт · ч кг -1 ), что резко контрастирует с их большой емкостью. Чжи и его коллеги сообщили о цинково-ионной батарее на основе положительного электрода с нанолентой Co 0,247 V 2 O 5 · 0,944H 2 O, которая обеспечивает 52,5% общей емкости выше 1,0 В и, следовательно, была получена высокая удельная энергия 432 Вт · ч кг −1 [102].Результаты показывают, что большая емкость Co 0,247 V 2 O 5 · 0,944H 2 O обусловлена его более сильной адсорбционной способностью для Zn 2+ , а высокое напряжение аккумулятора в основном из-за взаимодействия между орбиталями Co 3d и V 3d , которое перемещает относительный окислительно-восстановительный потенциал пары V 5+ / V 4+ на более высокий уровень (рис.
7H 2 O [100] и ванадат алюминия [101].Однако неприятным аспектом является то, что 80% их емкости находится ниже 1,0 В, что приводит к низкой плотности энергии (<250 Вт · ч кг -1 ), что резко контрастирует с их большой емкостью. Чжи и его коллеги сообщили о цинково-ионной батарее на основе положительного электрода с нанолентой Co 0,247 V 2 O 5 · 0,944H 2 O, которая обеспечивает 52,5% общей емкости выше 1,0 В и, следовательно, была получена высокая удельная энергия 432 Вт · ч кг −1 [102].Результаты показывают, что большая емкость Co 0,247 V 2 O 5 · 0,944H 2 O обусловлена его более сильной адсорбционной способностью для Zn 2+ , а высокое напряжение аккумулятора в основном из-за взаимодействия между орбиталями Co 3d и V 3d , которое перемещает относительный окислительно-восстановительный потенциал пары V 5+ / V 4+ на более высокий уровень (рис.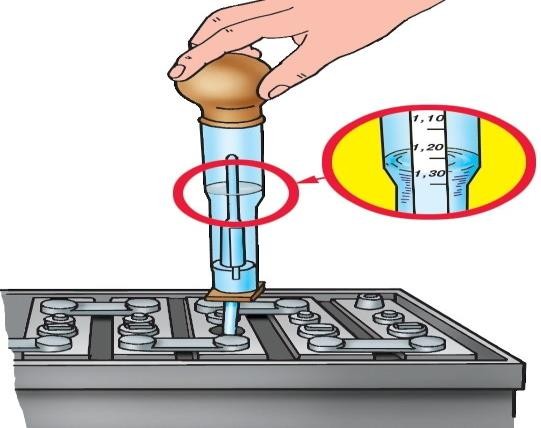 16d).
16d).
Материалы типа NASICON имеют большие каналы и способность к быстрой диффузии ионов и очень привлекательны в качестве узлов хранения Zn 2+ -ion.Na 3 В 2 (PO 4 ) 3 был зарегистрирован как положительный электрод водной Zn-ионной батареи с напряжением 1,1 В, 97,5 мАч g −1 емкостью, но недостаточной цикличностью (сохранение емкости 74% после 100 циклов) [103]. Недавно сообщалось о другом материале типа NASICON, Na 3 V 2 (PO 4 ) 2 F 3 , как о высоковольтном положительном электроде (более 1,6 В) для цинк-иона. аккумулятор, с окислительно-восстановительным потенциалом 0.На 5 В выше, чем у Na 3 V 2 (PO 4 ) 3 [104]. Собранный цинк-ионный аккумулятор имеет высокий потенциал 1,62 В и высокую плотность энергии 97,5 Вт · ч кг −1 (рис. 17a). Что еще более важно, при плотности тока 1 A g -1 цинк-ионная батарея показала очень стабильную производительность при циклической работе, сохраняя 95% емкости в течение 4000 циклов (рис. 17b).
17b).
a Кривые заряда-разряда первых трех циклов CFF-Zn // Na 3 В 2 (PO 4 ) 2 F 3 @C батареи ( 0.08 A г −1 ). b Циклические характеристики CFF-Zn (углеродная пленка, функционализирующая Zn) // Na 3 V 2 (PO 4 ) 2 F 3 @C батареи (1 A g −1 ) [104]. Воспроизведено с разрешения Ref. [104]. Copyright 2018, Elsevier BV. Сравнение производительности Zn / Co (III) rich-Co 3 O 4 батарей в 1 M KOH и 2 M ZnSO 4 с 0,2 M CoSO 4 : a заряд-разряд кривые, b производительность первых 500 циклов (1 A g −1 ) [105].Воспроизведено с разрешения Ref. [105]. Авторское право 2018, Королевское химическое общество
Как правило, в цинково-кобальтовых батареях используется щелочной электролит, который демонстрирует плохую стабильность при циклической работе и вызывает загрязнение окружающей среды. Окислительно-восстановительная реакция между CoO и Co 3 O 4 была обнаружена в батарее Zn / Co 3 O 4 с мягким водным электролитом [105]. Слой СоО, сформированный во время процесса разряда, показывает процесс преобразования внедрения ионов H + в Со 3 О 4 .Батарея с высоким содержанием Zn / Co (III) Co 3 O 4 , использующая слабый водный электролит, показала окно напряжения около 2,2 В (рис. 17c, d), что намного шире, чем у батареи с щелочными электролитами ( около 1,9 В).
Окислительно-восстановительная реакция между CoO и Co 3 O 4 была обнаружена в батарее Zn / Co 3 O 4 с мягким водным электролитом [105]. Слой СоО, сформированный во время процесса разряда, показывает процесс преобразования внедрения ионов H + в Со 3 О 4 .Батарея с высоким содержанием Zn / Co (III) Co 3 O 4 , использующая слабый водный электролит, показала окно напряжения около 2,2 В (рис. 17c, d), что намного шире, чем у батареи с щелочными электролитами ( около 1,9 В).
Водные магниево-ионные аккумуляторы (AMIB)
Магниево-ионные аккумуляторы постепенно становятся еще одной популярной областью исследований, поскольку ресурсы Земли богаты магнием, который является недорогим и пригодным для разработки устройств хранения энергии.Ион магния похож на ион лития. Однако основные проблемы, связанные с неводными перезаряжаемыми Mg-ионными батареями, препятствуют их развитию: (а) их электролит чувствителен к воде и имеет сложные химические свойства; (б) отсутствие высокоэффективных электродных материалов также ограничивает практическую применимость Mg-батарей из-за медленной диффузии Mg 2+ в твердых телах. Напротив, водные ионно-магниевые батареи (AMIB) имеют много преимуществ, таких как низкая стоимость, отсутствие коррозии, хорошая безопасность и хорошая проводимость.Однако из-за отсутствия подходящих материалов для отрицательного и положительного электрода большинство заявленных электродных материалов для AMIB оценивались только на полуэлементной установке. Ограниченные окном стабильности напряжения традиционных водных электролитов (1,23 В), напряжение и плотность энергии AMIB также очень ограничены [106]. Общеизвестно, что Mg трудно обратимо осаждать и отделять в водном растворе, поскольку Mg является активным металлом и имеет низкий окислительно-восстановительный потенциал (-2,37 В противОНА). Недавние исследования показали, что обратимое осаждение / удаление металлического магния в электролите, содержащем H 2 O, возможно путем введения искусственной твердой поверхности раздела. Наша группа сообщила о гибридной батарее Mg / LiFePO 4 , в которой реактив Гриньяра на основе магния применялся в качестве отрицательного электрода для неводного электролита, а LISICON служил в качестве комбинированного сепаратора / твердого электролита. Эта гибридная батарея продемонстрировала среднее напряжение разряда 2,1 В, стабильное плато разряда и хорошие циклические характеристики (рис.18а – в) [107].
Рис. 18a Схематическое изображение водной батареи Mg / LiFePO 4 . b Кривая заряда – разряда первого цикла (50 мАч g –1 , 1,7–3,4 В). c Циклические характеристики (50 мАч g −1 , 1,7–3,4 В) [107]. Воспроизведено с разрешения Ref. [107]. Авторское право 2015, Издательская группа Nature. d Сравнение циклических характеристик Mg / V 2 O 5 и Mg (с межфазной защитой) / V 2 O 5 дюйм 0.5 M Mg (TFSI) 2 / PC электролиты без / с водой. e Кривые заряда-разряда для Mg / V 2 O 5 и Mg (межфазная защита) / V 2 O 5 в 0,5 M Mg (TFSI) 2 / PC + 3 MH 2 электролита O (0,5–2,5 В, 29,4 мА г –1 ). Воспроизведено с разрешения Ref. [108]. Copyright 2018, Nature Publishing Group
Недавно искусственная Mg 2+ -проводящая межфазная поверхность на поверхности отрицательного электрода из Mg была синтезирована путем термоциклирования полиакрилонитрила и Mg (OTf) 2 .Искусственная граница раздела позволила осуществить обратимое циклирование полной ячейки Mg / V 2 O 5 в водосодержащем электролите на основе карбоната (рис. 18d, e) [108]. В таблице 3 и на рис. 18 приведены подробные сведения о производительности AMIB, о которых сообщалось на сегодняшний день.
Водные Ca-ионные батареи (ACIB)
Химические свойства Ca 2+ очень похожи на свойства Mg 2+ . Хотя радиус катиона Ca 2+ (0,100 нм) больше, чем у Li + (0.076 нм) и катионов Mg 2+ (0,072 нм), его окислительно-восстановительный потенциал низкий (–2,87 В относительно SHE), богат запасами и низкая плотность ионного заряда, что делает его альтернативным анодным материалом для пост-Li- ионные батареи. ACIB также является потенциальной электрохимической системой. Известно немного материалов электродов с интеркаляцией кальция, в основном из-за медленной диффузии Ca 2+ . В настоящее время немногие зарегистрированные материалы положительных электродов для ACIB представляют собой в основном PBA [включая NiHCF [109], K 2 BaFe (CN) 6 [110] и CuHCF [111]]), а указанные отрицательные материалы в основном являются органическими. электродные материалы, такие как PNDIE {поли- [N, N ‘- (этан-1,2-диил) -1,4,5,8-нафталинтетракарбоксиимид]} [112].
До сих пор сообщалось только об одном ACIB, состоящем из отрицательного электрода PNDIE и PBA, гексацианоферрата меди {CuHCF, K 0,02 Cu [Fe (Cu) 6 ] 0,66 · 3,7H 2 O }, в качестве положительного электрода и водный раствор Ca (NO 3 ) 2 в качестве электролита (рис. 19) [112]. Полная батарея продемонстрировала удельную емкость 40 мАч g -1 при 1 ° C (1 C = 40 мАч g -1 ) со средним рабочим напряжением 1,24 В, что соответствует удельной энергии 54 Втч кг — 1 , и сохранение емкости 88% с почти 100% кулоновским КПД после 1000 циклов при 10 C.
Рис. 19a Принципиальная схема заряда и разряда водной перезаряжаемой Ca-ионной батареи (PNDIE // Ca 0,3 CuHCF). b CV-кривые электродов и электрохимическая стабильность электролита [2,5 M Ca (NO 3 ) 2 , 1 мВ с −1 ]. c График зависимости напряжения от времени для аккумуляторов PNDIE // Ca 0,3 CuHCF (450 мАч g −1 ). d Циклические характеристики PNDIE // Ca 0.3 батарейки CuHCF (400 мАч g −1 ). Воспроизведено с разрешения Ref. [112]. Copyright 2017, Wiley – VCH
Алюминиево-ионные батареи на водной основе (AAIB)
Алюминий обладает высокой удельной объемной емкостью (8046 мА · ч · см −3 ) и высокой гравиметрической емкостью (2980 мА · ч · г −1 ), что составляет сравним с металлическим Li, имеет высокое содержание (около 8 мас.% земной коры) и является самым дешевым в производстве, за исключением железа. Кроме того, металлический алюминий имеет лучшую стабильность на воздухе, чем литий, что снижает потенциальные риски для безопасности, а также является экологически чистым.Введение ионных жидкостей при комнатной температуре (RTIL) с широким электрохимическим окном стабильности улучшило обратимость процесса удаления / нанесения покрытия из Al — прорыв, открывший жизнеспособный путь для перезаряжаемых алюминиево-ионных батарей (AIB) [113, 114, 115]. В последние годы успешное приготовление новых электролитов и лучшее понимание природы SEI привело к развитию AAIB [116, 117]. Многие исследователи исследовали новые электродные материалы для AAIB, такие как TiO 2 [118,119,120,121], MoO 3 [122, 123], WO 3 [124], FeVO 4 [125] и PBA [126,127,128]). , а некоторые обзоры всесторонне резюмировали эту работу [129,130,131,132].Поэтому мы обсудим этот аспект только кратко и сосредоточимся на недавнем прогрессе в исследованиях высокоэнергетических перезаряжаемых AAIB на основе металлического алюминия. В таблице 3 представлены подробные сведения о производительности AAIB, о которых сообщалось на сегодняшний день.
Использование алюминия в качестве отрицательного электрода AAIB — захватывающий прорыв. 5 м водный раствор трифторметансульфоната алюминия [Al (OTf) 3 ] описан как электролит с потенциальным окном от — 0,3 до 3,3 В (по сравнению с Al 3+ / Al) и способностью получать обратимое осаждение / удаление алюминий (рис.20) [116]. На основе этого электролита AAIB был собран с отрицательным электродом из металла Al и положительным электродом из Al x MnO 2 · n H 2 O, который имел средний потенциал (1,1 В) и выдающаяся плотность энергии 481 Втч кг −1 [117].
Рис.20a Окно электрохимической стабильности 5 м водного раствора Al (OTF) 3 (стеклоуглерод, 10 мВ с −1 ). b Кривая постоянного тока для заряда-разряда симметричного элемента Al – Al (5 м Al (OTF) 3 ). c Кривая заряда-разряда первых пяти циклов батареи Al-MnO 2 . d Циклические характеристики батареи Al – MnO 2 . Воспроизведено с разрешения Ref. [117], Copyright 2019 Nature Publishing Group
Хорошо известно, что пассивирующий слой Al 2 O 3 быстро и необратимо образуется на поверхности металлического Al в воздухе, что препятствует усилиям по превращению воды в воду с высокой степенью обратимости. электрохимические ячейки на основе алюминия.Недавно сообщалось, что обогащенная ионной жидкостью (ИЖ) межфазная поверхность на поверхности Al может быть получена путем погружения Al в кислотный электролит ИЖ, состоящий из AlCl 3 — [EMIm] Cl, на более чем 1 день, что привело к коррозии пассивирующая пленка Al 2 O 3 и предотвращала ее последующее образование [117]. Кроме того, этот вид интерфейса является постоянным и способствует миграции Al 3+ . Используя этот искусственный SEI, была создана водная батарея T – Al (обработанный IL Al анод) // MnO 2 с использованием водных электролитов Al (CF 3 SO 3 ) 3 , которые могли быть переработан и не показал значительного выделения водорода.Этот AAIB показал среднее напряжение 1,37 В и напряжение плато 1,40 В, обеспечивая удельную энергию около 500 Вт · ч · кг −1 (рис. 21). Производительность была дополнительно улучшена путем предварительного добавления 0,5 м MnSO 4 в водный электролит Al (OTf) 3 , который аналогичен батарее Zn / MnO 2 , где соль Mn 2+ улучшает оба емкость и циклические характеристики электрода из оксида марганца [133]. Эта батарея T-Al / 0,5Mn / Bir-MnO 2 продемонстрировала замечательную плотность энергии (620 Вт · ч кг -1 на основе массы MnO 2 типа бирнессита) и высокую сохраняющуюся емкость.
Рис. 21СЭМ-изображение Al фольги (слева) и фольги T – Al (справа). b Кривая постоянного тока для заряда-разряда симметричных ячеек Al – Al и T – Al / T – Al [2 м Al (CF 3 SO 3 ) 3 ]. Воспроизведено с разрешения Ref. [116]. Авторское право 2018, AAAS. c Кривые гальваностатического разряда / заряда водных алюминиевых аккумуляторных батарей [2 м Al (CF 3 SO 3 ) 3 , 100 мА г -1 ]. d Вторые кривые разряд – заряд при постоянном токе для Al / Bir-MnO 2 , T – Al / Bir-MnO 2 и T – Al / 0.Аккумуляторы 5Mn / Bir-MnO 2 (100 мАч г −1 ). e Циклические характеристики батарей T – Al / Bir-MnO 2 и T – Al / 0,5Mn / Bir-MnO 2 . Воспроизведено с разрешения Ref. [133]. Copyright 2019, Wiley – VCH
WiS водный AlCl 3 в качестве электролитов был применен для создания AAIB на основе металлического Al, состав которого смог снизить начальный потенциал реакции выделения водорода до прибл. –2,3 В (по сравнению с Ag / AgCl), что позволило Al 3+ осесть на алюминиевый отрицательный электрод и расширить окно электрохимической стабильности AAIB примерно до 4 В [134].На основе этого электролита был успешно собран алюминиево-графитовый аккумулятор с высокой удельной емкостью до 165 мАч g −1 , отличной стабильностью с сохранением емкости почти 99% и удельной энергией 220 Втч кг −1 . (Рис.22).
Рис. 22a Принципиальная схема алюминиево-графитовой батареи во время разряда. b Зарядно-разрядные кривые постоянного тока алюминиевых графитовых ячеек при различных плотностях тока. c Циклические характеристики алюминиево-графитовых батарей (500 мА г −1 ).Воспроизведено с разрешения Ref. [134]. Авторское право 2019 г., Королевское химическое общество
Из-за ограниченной растворимости Al (OTf) 3 в воде очень трудно получить аналогичный электролит WiS для AAIB. Однако другие хорошо растворимые соли, такие как LiTFSI, могут быть введены для образования электролитов WiS. Например, смешанный электролит, содержащий 1 м Al (OTf) 3 + 17 м LiTFSI + 0,02 м HCl, был использован для создания перезаряжаемой водной батареи Al – S [135]. В этом смешанном электролите сверхконцентрированный LiTFSI не только ингибировал гидролиз полисульфида на положительном электроде, но также уменьшал побочную реакцию выделения водорода на отрицательном электроде, в то время как добавка HCl предотвращала образование пассивирующего слоя на поверхности отрицательного электрода.Собранная батарея Al – S имела начальную емкость 1410 мАч г −1 (в пересчете на массу серы) и сохраняла обратимую емкость 420 мАч г −1 после 30 циклов с приемлемой кулоновской эффективностью 97% ( Рис.23).
Рис. 23a Гальваностатические кривые заряда – разряда первых двух циклов аккумуляторов Al (Al (OTf) 3 + LiTFSI + HCl‖S / C (200 мА г −1 ). b Циклические характеристики аккумуляторов AlAl (OTf) 3 + LiTFSI + HCl‖S / C (200 мА г −1 ).Воспроизведено с разрешения Ref. [135]. Авторское право 2020, Королевское химическое общество
. Не допускается переворачивать АКБ для слива. В этом случае осыпавшиеся частицы со дна могут замкнуть пластины. Или электроды деформируются, порвут сепаратор и будет замыкание. В случае замыкания банки аккумулятор можно смело идти сдавать в приёмку.
Не допускается переворачивать АКБ для слива. В этом случае осыпавшиеся частицы со дна могут замкнуть пластины. Или электроды деформируются, порвут сепаратор и будет замыкание. В случае замыкания банки аккумулятор можно смело идти сдавать в приёмку. Поэтому не нужно стучать и прикладывать излишних усилий чтобы снять клемму на аккумуляторе. Лучше потратить немного больше времени и сделать это аккуратно.
Поэтому не нужно стучать и прикладывать излишних усилий чтобы снять клемму на аккумуляторе. Лучше потратить немного больше времени и сделать это аккуратно.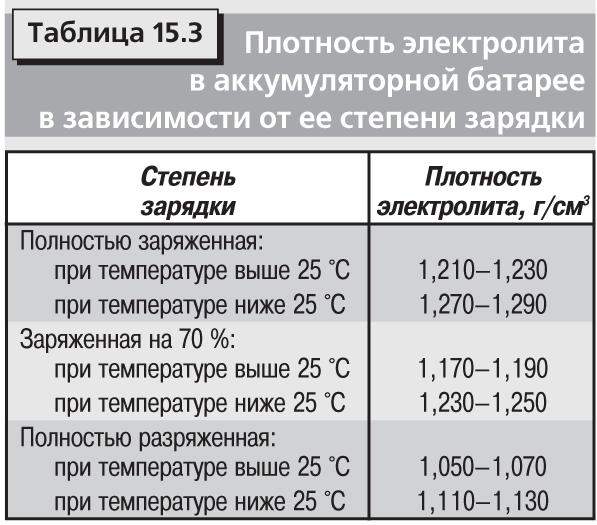 Если сделать наоборот – раствор начнет бурно кипеть.
Если сделать наоборот – раствор начнет бурно кипеть.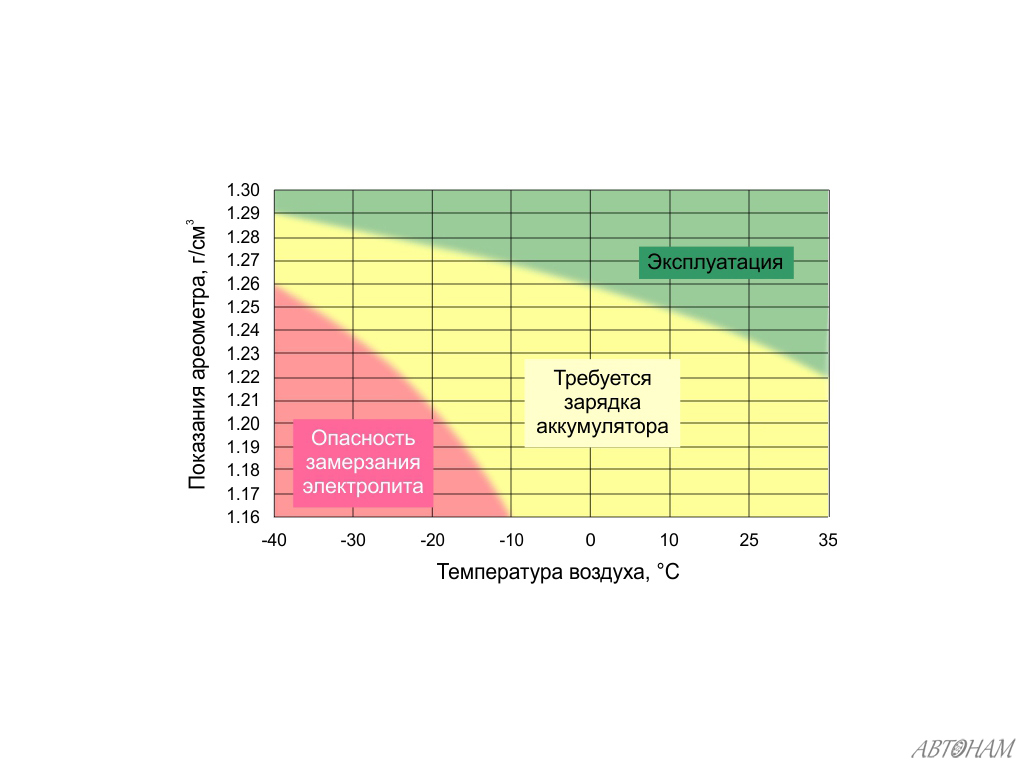 Т.е. банка перестает работать.
Т.е. банка перестает работать.
 Сделать этом можно при помощи специального прибора – ареометра. При этом работать можно только в перчатках и защитных очках, чтобы избежать возможных ожогов.
Сделать этом можно при помощи специального прибора – ареометра. При этом работать можно только в перчатках и защитных очках, чтобы избежать возможных ожогов.



 Обратите внимание, обратный порядок не допускается, то есть в кислоту нельзя заливать воду. Не забудьте надеть резиновые перчатки.
Обратите внимание, обратный порядок не допускается, то есть в кислоту нельзя заливать воду. Не забудьте надеть резиновые перчатки.