Способность топлив к электризации В известных условиях среднедистиллятные углеводородные топлива могут электризоваться. В этом случае в объеме жидкости накапливаются заряды электростатического электричества, разность потенциалов которых может достигнуть большой величины, превысить пробивное напряжение и стать причиной электрических искровых разрядов вблизи поверхности раздела фаз топливо—воздух. Анализ 63 несчастных случаев, связанных с накоплением в нефтяных топливах статического электричества, выявил следующие причины взрывов и пожаров (в %): Взрыв паровоздушной топливной смеси из-за чрезмерного скопления статического электричества возникает лишь при определенных условиях. К их числу относятся следующие: 1. Накопление электрического заряда достаточной величины. 2. Наличие над жидким топливом паровоздушной смеси, в которой топливные пары будут находиться в пределах взрывоопасных концентраций. 3. Электрический разряд должен быть настолько мощным, чтобы вызванная им искра явилась источником взрыва паровоздушной топливной смеси. Возникновение этих условий определяется многочисленными факторами, часть которых зависит, от физико-химической характеристики топлив, а часть —от условий их эксплуатации (прежде всего от условий хранения, чистоты, скорости перекачивания, перемешивания и др. Пожарная безопасность топлив определяется главным образом их температурой вспышки. Именно этот показатель положен в основу классификации топлив многих стран. Температура вспышки определяется пределами выкипания топлив, а следовательно, их фракционным составом. Взрывоопасные концентрации паровоздушной топливной смеси также зависят от фракционного состава топлив. Для авиационных топлив пределы взрывоопасных концентрацией с увеличением высоты полета (понижения атмосферного давления) будут смещаться в сторону более низких температур. На рис. 41 показано изменение температуры вспышки нефтяных дистиллятных топлив в зависимости от их плотности, а на рис. 42 — смещение температурных пределов взрывоопасных концентраций паровоздушных смесей авиационных топлив с изменением атмосферного давления (высоты полета и температуры). Пределы взрывоопасных концентраций паровоздушных топливных смесей обычно составляют от 1,3 до 7 объемн. %. Для легких дистиллятов этот предел определяется весовым отношением: пары топлива : воздух=1 : 8— 1 : 18. Замечено, что из-за различных условий (конфигурация топливного резервуара и парогазового пространства, повышенная концентрация растворенного кислорода в топливе, давление в емкости, вспениваемость топлива из-за перемешивания, налива или перекачки) температура вспышки топлива приблизительно на 7°С ниже, чем по данным лабораторного определения. Пожарная безопасность определяется также проводимостью топливом электричества. Углеводородная смесь плохой проводник электричества. Ее удельное сопротивление очень велико. Ниже приведены значения удельных сопротивлений некоторых нефтепродуктов (в ом•м): Минимальная энергия искрового разряда, достаточная для воспламенения смеси, должна составлять не менее 0,20—0,25 мдж. Пробивной градиент потенциала воздуха, при котором общая напряженность поля достигнет величины, вызывающей разряд, составляет (3—5) -106 в/м. В то же время известно, что искровой разряд возможен при напряжении более 300—330 в. Накапливание электрического заряда опасной величины обусловлено ничтожными количествами органических и неорганических примесей к углеводородам. К органическим примесям, характеризующимся значительно большей полярностью, чем углеводороды, относятся сернистые, азотистые и все кислородные соединения, включая смолы. К неорганическим примесям относятся вода — растворенная, кристаллическая (при низких температурах) и эмульсионная, газы, в том числе кислород воздуха, насыщающие топливо, минеральные загрязнения (продукты коррозии и износа металлов, почвенная пыль) и другие загрязнения. Особенно опасны нерастворимые в топливе примеси, присутствующие в виде мелкодисперсных суспензий и эмульсий с частицами размером менее 1 мк, характерными для коллоидной системы. Такие частицы, содержание которых в 1 мл топлива достигает десятков тысяч, легко ионизируются, что приводит к накоплению статического электричества. Электрический потенциал топлив возрастает под влиянием повышенных температур, ультрафиолетового и ионизирующего излучения. Так, из бензино-лигроино-керосиновой фракции, содержавшей всего лишь 0,08% серы, после ультрафиолетового облучения выделен осадок (0,05%), оказавшийся мощным генератором электричества. Осадок имел следующий состав (в %): С—57,32; Н -6,60; О—24,19; S—5,07; N—3,59; зола (окислы железа) — 0,09. (С30Н41O9,4 N1.6S). После удаления загрязняющих примесей из керосина прямой перегонки удельная проводимость топлива значительно снизилась. Это видно из следующих данных (в 10-12 • ом-1 • см-1): По мере накопления продуктов окисления проводимость топлива возрастает. Интересно, что проводимость возрастает и при индукционном периоде, когда количественно оценить поглощенный кислород не представляется возможным. В дизельном топливе индукционный период составляет около 20 ч, для метилдодецена более 40 ч, а для додецил бензол а более 20 ч. Именно у додецилбензола проводимость после 44 ч окисления достигла такой величины, которая в дизельных топливах и метилдодецене наблюдалась лишь через 150 ч окисления. По-видимому, продукты окисления метилдодецена оставались преимущественно в виде истинного раствора в углеводороде, а в додецилбензоле в виде мелкодисперсной фазы с частицами размером, характерным для коллоидного раствора. Подобно додецил бензолу окислялись и дизельные топлива, содержавшие значительное количество ароматических углеводородов. Таким образом, длительность хранения топлив, степень их окисления оказывают большое влияние на проводимость и, следовательно, на скорость и величину накопления заряда электростатического электричества. Релаксация (и в связи с этим последующее исчезновение накопленного в топливе электрического заряда) является функцией времени и определяется проводимостью жидкости. Чем выше проводимость, тем меньше времени необходимо для релаксации заряда, тем быстрее выравнивается разность потенциалов. Для топлив с одинаковой диэлектрической проницаемостью скорость рассеивания заряда тем больше, чем больше проводимость. Нa рис. 43 приведена кривая записи нарастающей напряженности поля во время заправки бака самолета топливом. Удельная проводимость нефтепродуктов возрастает с повышением пределов их выкипания, что связано с содержанием неуглеводородных примесей (кислородных, сернистых, азотистых соединений, смол и соединений с зольными элементами). Удельная проводимость (в 10-14 •ом-1 •см-1) некоторых нефтепродуктов приводится ниже: Проводимость бензино-лигроино-керосиновых фракций прямой перегонки мало различается и составляет 0,1 —1,0•10-14 •ом-1 • см-1. Для авиационных топлив, находящихся в аэропорту, эта величина может возрастать до 10 • 10-14•ом-1 •см-1. При увеличении температуры топлива на 20 °С величина проводимости возрастает более чем на половину. Электризация топлив резко возрастает с увеличением скорости их передвижения по трубам, распиливания с образованием капельно- и паровоздушной смеси. Характер движения жидкого топлива также оказывает значительное влияние на величину накапливающегося статического электричества (рис. 44). При низких температурах многие топливопроводящие материалы становятся в большей степени диэлектриками (например, гибкие шланги), благодаря чему в емкость топливо поступает с большим электрическим зарядом. Шероховатая, загрязненная продуктами коррозии металлическая поверхность, соприкасающаяся с топливом, способствует накоплению статического электричества гораздо в большей степени, чем очищенная и гладкая поверхность. Возникновение и накопление электричества при перекачке или перемешивании (аэрации) топлива объясняется сосредоточением ионов на поверхности раздела фаз. Неуглеводородные соединения, загрязняющие топлива, при этом диссоциируют на положительные и отрицательные ионы. При неподвижном топливе ионы с противоположным зарядом образуют вблизи внутренней стенки трубы более или менее стабильный слой зарядов, благодаря чему создается как бы нейтральная электрическая система. О том, как велико влияние скорости перекачки на величину заряда дают представление результаты замера электростатического потенциала, возникавшего при перекачке дизельного топлива из бака в бак на лабораторной установке через медную трубку диаметром б мм и длиной 500 мм. Режим движения топлива был ламинарный. Электростатический потенциал измерялся относительно земли. При скоростях перекачки 1,6; 2,8; 3,8 м/сек напряжение составляло соответственно 590, 1110, 1630. Практически все материалы, контактирующие с углеводородным топливом (топливопроводы, баки, емкости, технические средства из резины и пластмассы, фильтры, особенно бумажные, замшевые, суконные и тканевые, водосепараторы) являются мощными, генераторами электрического заряда. В этом отношении их влияние гораздо сильнее, чем скорость и характер перекачки топлива. Для предотвращения пожаров и взрывов углеводородных топлив в связи с накоплением статического электричества следует исключить возможность появления искровых разрядов в паровоздушном пространстве над топливом и довести до минимума возникающий заряд в жидкой фазе топлива. Замечено, что топливо практически не заряжается при проводимости менее 1 • 10-14 •ом•-1см-1. Такое топливо характеризуется высокой чистотой, поддерживать которую практически весьма трудно. Чтобы избежать опасности искровых разрядов при использовании современных средств и методов заправки, удельная проводимость топлива должна быть не менее 50• 10-14•ом-1•см-1. Обследование проводимости авиационных топлив во многих международных аэропортах, расположенных в различных странах мира, позволило получить интересные данные. В 13% обследованных партий топлив проводимость была ниже 1 • 10-14•ом-1 •см-1 в 70%— ниже 5• 10-14• ом-1 • см-1. Эти значения свидетельствовали о весьма высокой степени чистоты топлив. Между тем, проводимость образцов топлив, отобранных в аэропортах, была выше, чем в емкостях нефтеперерабатывающих заводов. На рис. 45 приведены данные о проводимости образцов реактивных топлив, отобранных в различных аэропортах. Кроме проведения мероприятий, ограничивающих загрязнение, обводнение, аэрацию, перемешивание, чрезмерно быструю перекачку и излишнюю фильтрацию топлив, все больше внимания уделяется присадкам, введением которых можно повысить проводимость топлив, исключив тем самым скопление опасных по величине зарядов статического электричества. Известно много патентов, в которых в качестве таких присадок предлагаются металлооргаиические соединения или соли. Наиболее эффективные присадки, вводимые в топлива в количестве 0,001—0,05 вес. %, увеличивают проводимость у бензинов с 0,3• 10-12 до 10• 10-12 ом-1 •м-1, у реактивного топлива с 0,02• 10-12 40 • 10?12 ом-1 • м-1 до значений выше 10-10 ом-1•м-1. Примером может служить присадка фирмы «Shell» ASA-3, представляющая собой смесь трех компонентов: алкилсалицилат хрома с 14—18 атомами углерода в алкильной группе, ди-(2-этилгексил)-сульфосукцинат кальция и не содержащий металла органический полимер. Добавление 0,0001% такой присадки сообщает топливу проводимость, равную 50 • 10-14•ом-1•см-1. Такие присадки применяются пока мало. Одним из недостатков применения присадок является введение; ними в топливо крайне нежелательных зольных элементов — металлов. Наряду с присадками наиболее эффективной мерой предотвращения скопления недопустимых по мощности зарядов статического электричества является ограничение скорости перекачки топлива. При перекачке топлива со скоростью 6 м/сек большая часть электрического заряда рассеивается в шланге на стороне выдачи топлива. Однако если в шланге создается двухфазная система топливо— вода или топливо — воздух, скорость перекачки следует снизить до 1 м/сек. В современных транспортных реактивных самолетах топливная заправка достигает 60 м3. Предельной эксплуатационной скоростью заправки топливом таких самолетов считается 3.8 м3/мин. Возможно, в связи с такими ограничениями взрывы из-за чрезмерного накопления статического электричества в топливных баках самолетов в гражданской авиации не наблюдаются. К весьма эффективным мерам, предотвращающим или ограничивающим накопление статического электричества, относится систематическая очистка топлив от загрязняющих пэимесей органического и минерального характера. Очистка топлив от загрязнений достигается в процессе производства, а также фильтрацией, отделением воды, максимально возможной изоляцией от кислорода воздуха, действия света, повышенной температуры и др. Топливо рекомендуется хранить в резервуарах с плавающими крышами, что ограничивает объем паровоздушной смеси над ним. Заполнение емкости свободно падающей струей топлива может привести к появлению высоких потенциалов и разрядов, электричества. Поэтому заполнять емкость через газовое пространство свободной струей чрезвычайно опасно. Топливо необходимо закачивать под слой топлива. Для уменьшения ,.его разбрызгивания применяют направляющие диффузоры, распределяющие топливо по придонной части емкости. Технические средства, предназначенные для топлив (резервуары, перекачивающие механизмы, топливный транспорт, трубопроводы), должны быть тщательно заземлены при их эксплуатации. Не получили пока широкого распространения предложенные специальные конструкционные материалы, ускоряющие релаксацию накопившегося статического электричества в топливе, а также применение инертного очищенного газа для заполнения над топливного пространства в емкостях. Для измерения напряженности электростатического поля разработаны приборы. В одном из них вращающаяся пластинка в отсутствие поля наклонена под углом 30° к горизонтали. При помещении в электрическое поле на ней индуцируются заряды, и она поворачивается против часовой стрелки, преодолевая натяжение пружины. На этой же оси расположен переменный конденсатор, включенный в контур радиочастотного генератора. Изменение частоты генератора фиксируется приемником на крыше резервуара. Питается генератор от имеющихся в нем батарей. Предложены приборы других систем: световой и звуковой сигнализации для обнаружения статического электричества. Описан прибор «ЕR» для определения электризуемости топлива. В нем непрерывно циркулирует 3,8 л топлива со скоростью 15.2 л/мин через трубу из нержавеющей стали диаметром 25 мм., заполненную стекловатой. Микроамперметром измеряется количество электростатических зарядов, поступающих в резервуар. Электрические разряды, образующиеся в фильтре, регистрируются специальным радиоприемником. |
Электропроводность неорганических веществ — Справочник химика 21
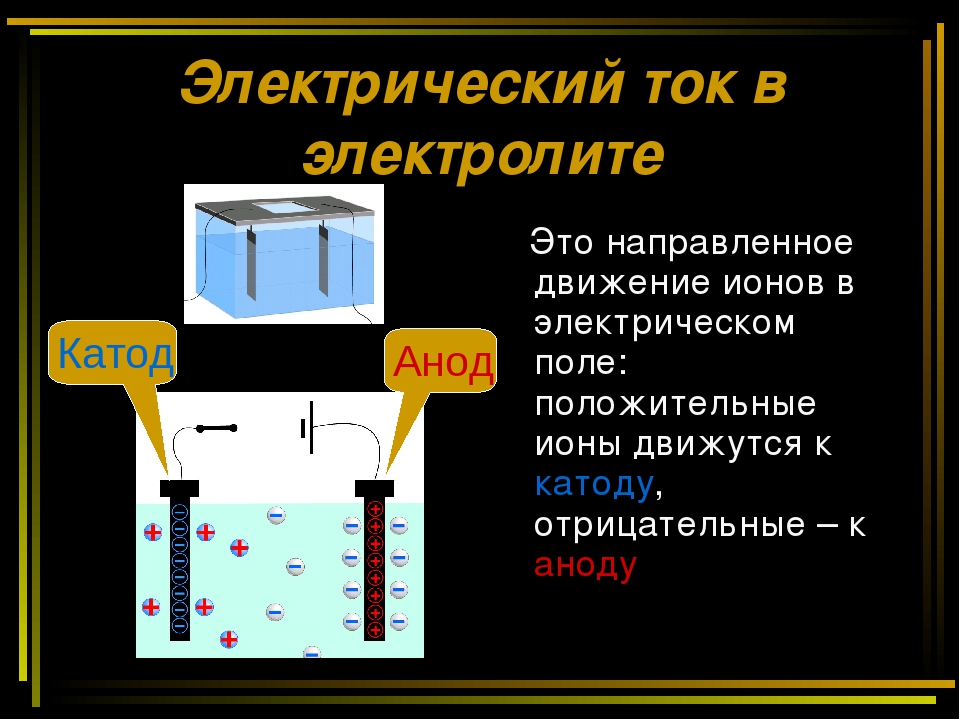
Химически чистая вода практически не проводит электрического тока.
 Водные растворы многих органических веществ (спиртов, альдегидов, кетонов, углеводов) также не-электропроводны. Но при растворении неорганических веществ (солей, кислот, оснований, большинства оксидов) раствор приобретает электрическую проводимость. [c.203]
Водные растворы многих органических веществ (спиртов, альдегидов, кетонов, углеводов) также не-электропроводны. Но при растворении неорганических веществ (солей, кислот, оснований, большинства оксидов) раствор приобретает электрическую проводимость. [c.203]Коллоидные растворы неорганических веществ и водные растворы многих высокомолекулярных органических соединений (белков, крахмала и др.) хорошо проводят электрический ток, но это явление гораздо сложнее, чем для электролитов. Для разбавленных растворов электролитов установлена вполне определенная зависимость между удельной электропроводностью х, концентрацией с, степенью электролитической диссоциации а и суммой абсолютных скоростей движения катиона к и аниона Иа [c.92]
При исследовании качества воды обращают внимание на ее цвет, запах, вкус, прозрачность воды (или ее мутность), изменения при хранении, определяют температуру, содержание взвещенных и растворенных примесей, в том числе СО2, жесткость, окисляемость органических и неорганических веществ, активную реакцию воды (кислотность или щелочность), электропроводность, а также бактериальную и радиоактивную загрязненность. [c.27]
Известно, что только фториды РЗЭ и различные соли серебра имеют ионную проводимость при комнатной температуре. Поэтому большой интерес представляют исследования по искусственному увеличению электропроводности кристаллических веществ за счет введения в структуру кристалла определенного количества примесей, которые увеличивают число дислокаций в кристаллической решетке и тем самым повышают концентрацию переносчиков тока. Отсутствие соединений с ионным характером проводимости заставило исследователей использовать в качестве чувствительных элементов ион-селективных электродов более сложные композиции, состоящие из смеси веществ с ионной проводимостью и труднорастворимого неорганического соединения, содержащего ион, одноименный с ионом активного компонента. Обычно в качестве активного компонента используют сульфид серебра. Механизм работы такого электрода основан на введении в осадок сульфида серебра сульфида другого металла с большим значением произведения растворимости, чем для сульфида серебра. В электропроводном слое в этом случае должны протекать реакции [c.143]
Механизм работы такого электрода основан на введении в осадок сульфида серебра сульфида другого металла с большим значением произведения растворимости, чем для сульфида серебра. В электропроводном слое в этом случае должны протекать реакции [c.143]
Несколько иные представления о растворах неорганических веществ развивали ученые, обращавшие особое внимание на тот (ракт, что растворы солей, кислот и оснований проводят электрический ток. Опираясь на работы русского ученого Ф. Гротгуса, создавшего теорию электропроводности растворов электролитов и английского ученого М. Фарадея, давшего основные законы [c.10]
Приведенные выше данные получены при изучении диффузии органических веществ в полимерах. При рассмотрении электропроводности наибольший интерес представляют данные о диффузии неорганических веществ типа ионов металлов и галогенов. К сожалению, соответствующих данных в литературе не имеется. [c.28]
Диаграммы состав—свойство для металлических систем широко применялись уже в первом десятилетии XX в. [4, II, 19 — 36]. Закономерности изменения электропроводности, твердости и их температурных коэффициентов позволили выявить ряд новых соединений определенного состава и так называемых неопределенных соединений . Продолжая работы Д. И. Менделеева, Н. С. Курнаков и для расплавов, и для растворов органических и неорганических веществ установил формы проявления прочных химических соединений, соединений диссоциированных и соединений, находящихся па грани перехода их в растворы. Как мы увидим далее, фазы переменного состава и первые соединения нестехиометрического состава для твердокристаллического состояния, имеющие в настоящее время такое большое значение при создании новых материалов — полупроводников и катализаторов и при определении реакционной способности вещества, были открыты и изучены именно в процессе построения диаграмм состав —физическое свойство. [c.5]
Свойства, рассмотренные выше, и особенно такие, как летучесть, растворимость и электропроводность, позволяют сделать для целого ряда соединений предположения о природе существующих в них химических связей. Однако в общем эти свойства не позволяют количественно судить о прочности сил связи и не дают каких-либо определенных сведений, по которым можно было бы четко определить строение. Прочность связей определяется либо из термохимических данных, либо измерением равновесий (например, определением давления разложения). Для изучения свойств, характеризующих строение неорганических веществ, имеется целый ряд специальных физических методов, важнейшие из которых следует здесь коротко рассмотреть. [c.298]
Однако в общем эти свойства не позволяют количественно судить о прочности сил связи и не дают каких-либо определенных сведений, по которым можно было бы четко определить строение. Прочность связей определяется либо из термохимических данных, либо измерением равновесий (например, определением давления разложения). Для изучения свойств, характеризующих строение неорганических веществ, имеется целый ряд специальных физических методов, важнейшие из которых следует здесь коротко рассмотреть. [c.298]
Хроматографический метод анализа анионов, описанный в предыдущей главе, заполнил огромный пробел в анализе неорганических веществ. Однако необходимость во второй (компенсационной) колонке усложняет оборудование и до некоторой степени ограничивает выбор элюента и разделительную способность метода. Несомненным достоинством системы было бы непосредственное подключение детектора электропроводности к анионообменной разделяющей колонке. Это возможно лишь в том случае, если концентрация солей в элюенте очень низка, а потому очень низка и фоновая проводимость. Однако обычные ионообменные смолы содержат много обмениваемых групп (в полистирольных смолах примерно одну на каждое бензольное кольцо), и для хроматографического разделения анализируемых ионов требуется применять элюент с высокой концентрацией солей. [c.102]
Коррозия металлов в неэлектролитах представляет собой разновидность химической коррозии. Органические жидкости, не обладающие электропроводностью, исключают возможность протекания электрохимических реакций. К ним относятся широко распространенные органические растворители, такие, как бензол, толуол, четыреххлористый углерод и жидкие топлива (мазут, керосин, бензин). Диэлектриком являются и некоторые неорганические вещества жидкий бром, расплавленная сера, жидкий фтористый водород. Коррозия в непроводящих средах независимо от их природы сводится к химической реакции между металлом и веществом. [c.52]
При изложении раздела Электропроводность растворов необходимо отметить, что законы Вант-Гоффа и Рауля справедливы только для идеальных растворов, в которых не происходит химического взаимодействия между компонентами раствора, а также нет диссоциации или ассоциации молекул растворенного вещества. Опыт показывает, что не все растворы подчиняются этим законам. Установлено, что растворы солей, кислот и оснований, которые способны проводить электрический ток (так называемые электролиты), имеют более высокое, чем это следует по закону Вант-Гоффа, осмотическое давление, кипят при более высокой и замерзают при более низкой температурах, чем это можно ожидать из закона Рауля. В демонстрационном опыте 20 довольно полно рассматриваются явления электропроводности растворов различных органических и неорганических соединений. [c.55]
Опыт показывает, что не все растворы подчиняются этим законам. Установлено, что растворы солей, кислот и оснований, которые способны проводить электрический ток (так называемые электролиты), имеют более высокое, чем это следует по закону Вант-Гоффа, осмотическое давление, кипят при более высокой и замерзают при более низкой температурах, чем это можно ожидать из закона Рауля. В демонстрационном опыте 20 довольно полно рассматриваются явления электропроводности растворов различных органических и неорганических соединений. [c.55]
В начале диализа при большой разности концентрации соли по обе стороны мембраны диализ протекает быстро, затем процесс постепенно замедляется. Обычно основную часть низкомолекулярных веществ (соли и т. д.) удаляют диализом против обычной проточной воды, а остаток — диализом против дистиллированной воды или дважды дистиллированной воды. Степень отделения низкомолекулярных веществ в процессе диализа можно определить при помощи различных аналитических методов осаждения, окрашивания и т. д. Для контроля процесса диализа неорганических ионов наиболее удобным способом является измерение электропроводности проб специальной пипеткой (рис. 213). В пипетку объемом 1—2 мл впаяны дисковые платиновые электроды, которые присоединены к измерительному прибору. В пипетку набирают раствор так, чтобы электроды были полностью погружены, и капиллярный кран перекрывают. Если диализуемый раствор содержит несколько различных электролитов, то пипетку калибруют, измеряя электропроводность растворов известной концентрации. В некоторых проточных диализаторах электроды вмонтированы непосредственно в прибор. [c.200]
Кондуктометрические кюветы. В хроматографическом анализе неорганических соединений за изменением концентрации можно следить по изменению электропроводности раствора. Для этой цели применяются проточные кондуктометрические кюветы, представляющие собой небольшой стеклянный сосуд с впаянными платиновыми электродами. Такая кондуктометрическая ячейка включается в качестве одного из плеч мостовой схемы, в диагональ которой подключается гальванометр или самопишущий потенциометр. Мост настраивается на сопротивление ячейки при заполнении ее растворителем. Появление в растворителе хроматографируемых веществ, изменяющих его электропроводность, вызывает разбалансировку моста, что и фиксируется самописцем. Во избежание смешения двух разделенных в колонке веществ кювета должна иметь возможно малый объем. [c.38]
Такая кондуктометрическая ячейка включается в качестве одного из плеч мостовой схемы, в диагональ которой подключается гальванометр или самопишущий потенциометр. Мост настраивается на сопротивление ячейки при заполнении ее растворителем. Появление в растворителе хроматографируемых веществ, изменяющих его электропроводность, вызывает разбалансировку моста, что и фиксируется самописцем. Во избежание смешения двух разделенных в колонке веществ кювета должна иметь возможно малый объем. [c.38]
В первый период своей деятельности, исследуя коллоидное состояние вещества в неорганической и органической природе и систематизируя свойства коллоидных систем на основе собственных исследований, применив методы электропроводности, диффузии, фильтрации, ультрамикроскопии, криоскопии, рефрактометрии, А. В. Думанский изучал свойства многих лиофобных золей, разрабатывал методы их получения и определял факторы, обусловливающие их устойчивость. Такое комплексное изучение золей, которое впервые осуществил А. В. Думанский, значительно расширило представление о природе золей. [c.3]
Более полная сводка значений удельной и эквивалентной электропроводностей для растворов различных концентраций неорганических и некоторых органических веществ приведена в Справочнике химика , т. 111, Госхимиздат, 1952, стр. 442—450 и в Кратком справочнике химика , Госхимиздат, 1963, стр. 426—428. [c.348]
Сопоставим свойства характерных представителей неорганических и органических веществ. Поваренная соль МаС1 — типичное неорганическое вещество — характеризуется высокой точкой плавления (800 °С), легко растворяется в воде, причем в растворе обнаруживаются ионы (это можно установить по электропроводности раствора). Другое соединение органическое — углеводород состава Qoh52 (углеводороды примерно такого состава находятся в парафине) представляет собой вещество с низкой точкой плавления — около 37 °С, Оно нерастворимо в воде, не диссоциирует на ионы.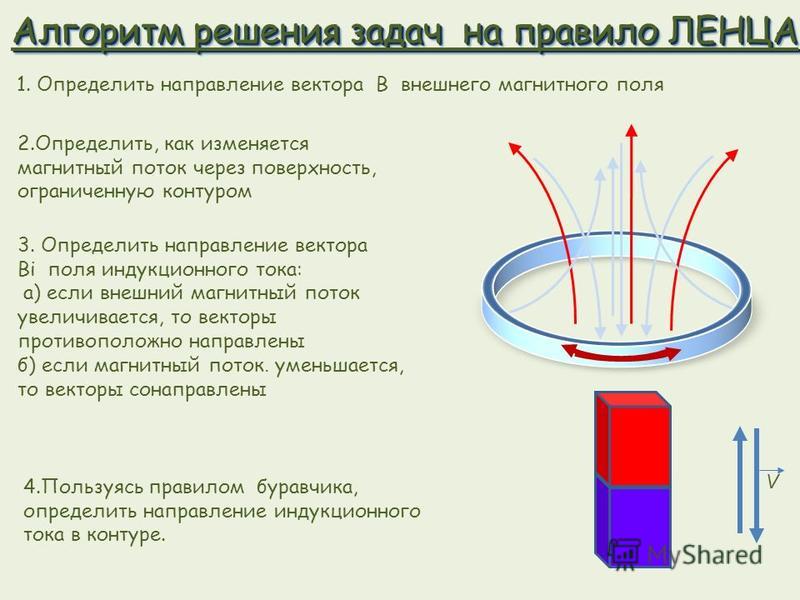 Можно подумать, что все дело в составе обоих веществ, но это не так. Если, например, хлор, входящий в состав хлорида натрия, может быть открыт при помощи качественной реакции с нитратом серебра, то тот же хлор в составе органического вещества, например хлороформа СНС1з, не переходит непосредственно в ионное состояние, не реагирует с нитратом серебра. [c.77]
Можно подумать, что все дело в составе обоих веществ, но это не так. Если, например, хлор, входящий в состав хлорида натрия, может быть открыт при помощи качественной реакции с нитратом серебра, то тот же хлор в составе органического вещества, например хлороформа СНС1з, не переходит непосредственно в ионное состояние, не реагирует с нитратом серебра. [c.77]
Коррозия металлов в неэлектролитах является разновидностью химической коррозии. Органические жидкости не обладающие электропроводностью, исключают возможность протекания электрохимических реакций. К неэлектролитам относятся органические растворители бензол, толуол, четыреххлористый углерод, жидкое топливо (мазут, керосин и бензин) и некоторые неорганические вещества, такие, как бром, расплав серы и жидкий фтористый водород. В этих средах коррозию вызывает химическая реакция между металлом и коррозионной средой. Наибольщее практическое значение имеет коррозия металлов в нефти и ее производных. Коррозионно-актив-ными составляющими нефти являются сера, сероводород, сероуглерод, тиофены, меркаптаны и др. Сероводород образует сульфиды с железом, свинцом, медью, а также со сплавами свинца и меди. При взаимодействии меркаптанов с никелем, серебром, медью, свинцом и со сплавами меди и свинца получаются металлические производные меркаптанов — меркапти-ды. Сера реагирует с медью, ртутью и серебром с образованием сульфидов. [c.15]
В водах, содержащих преимущественно неорганические вещества, т. е. в питьевых водах,- а также в большинстве поверхностных и некоторых сточных водах удельная электропроводность служит приблизительным показателем концентрации неорганических электро-литов. В сточных водах, содержаших соли пргяничргкиу к игипт или оснований, удельная электропроводность является ориентировочным показателем концентрации неорганических и органических электролитов. При анализе вод удельная электропроводность определяется при 20° С. Пробы нельзя консервировать. Рекомендуется проводить определение не позже чем через 1 сутки после отбора пробы. [c.52]
[c.52]
Сильные и слабые электролиты. Обычные неорганические кислоты (соляная, азотная, серная), неорганические основания и многие соли дают водные растворы, обладающие высокой электропроводностью. Эти вещества называются сильными электролитами-, в растворе они почти полностью ионизированы (диссоциированы). Другие вещества — гидроокись аммония (Nh5OH), уксусная кислота, хлорид ртути — обладают в растворах той же концентрации значительно меньшей проводимостью, чем сильные электролиты эти вещества называются слабыми электролитами. [c.166]
Рассмотрение механизмов реакции показало значение взаимодействия перекиси водорода не только с реагентами, но и с растворителем и другими растворенными вегцествами. В этом разделе рассматриваются некоторые свойства растворов перекиси водорода, которые влияют па протекающие в них реакции. Физическая природа растворов перекиси водорода освещена в гл. 6. Упомянутые в ней сообщения указывают иа высокую диэлектрическую проницаемость перекиси водорода и на близость ее к диэлектрической проницаемости воды. Правда, существуют определенные различия, но для большей их части пока еще нет надлежащего объяснения. Так, Бамбергер и Нуссбаум П71 указали, что вода и перекись водорода очень легко растворяют такие органические вещества, которые содержат больгное число гидроксильных групп, ио при росте молекулярного веса растворяемого вещества только сравнительно концентрированная перекись водорода сохраняет растворяющие свойства. Среди неорганических веществ имеются такие, которые лучнле растворимы или хуже растворимы в перекиси водорода, чем в воде. Электропроводности соле в растворах перекиси подорода, наоборот, очень близки к электропроводностям [c.328]
Благодаря общности закономерностей, лежащих в основе процессов кристаллизации, рассматриваемые методы могут быть использованы при изучении систем, образованных самыми различными объектами — металлами, полупроводниковыми и интерметаллическими соединениями, солями, низкоплавкими молекулярно-кристаллическими органическими и неорганическими веществами. Это показывает, что направленная кристаллизация превосходит поуни-версальпости те методы физико-химического анализа (например, кристаллооптический анализ или измерение электропроводности и микротвердости), которые отличаются определенной ограниченностью областей применения, обусловленной специфичностью природы объектов исследования. [c.126]
Это показывает, что направленная кристаллизация превосходит поуни-версальпости те методы физико-химического анализа (например, кристаллооптический анализ или измерение электропроводности и микротвердости), которые отличаются определенной ограниченностью областей применения, обусловленной специфичностью природы объектов исследования. [c.126]
Ламберт настоятельно рекомендует в качестве растворителя для полярографических исследований диметилформамид, который обладает высокой растворяющей спосббностью по отношению к веществам различной природы (в том числе и неорганическим веществам), относительно высокой диэлектрической постоянной, что обеспечивает хорошую ионизацию электролитов в нем и тем самым высокую электропроводность фона и т. д. В последние годы в ряде случаев применяются диметилсульфоксид, ацетонитрил, тетрагидрофуран, ЗОг, ССЬ и т. д. [c.303]
Низкомолекулярные вещества при введении в полимер часто уменьшают внутримолекулярное взаимодействие, что приводит к увели-, чению подвижности макромолекул и в результате к повышению электропроводности системы. Посторонние примеси и составные части компаундов могут выпотевать на поверхность изделия и таким образом снижать р5 [8, с. 427]. В работе [9] показано, что у политрифтор-этилена с различным содержанием примесей р отличаются на 1—3 порядка. Было установлено [10], что значение уменьшается на 3—3,5 порядка при увеличении количества неорганических веществ в полимере (зольности) от 0,06 до 1,9%. При повышении концентрации пластификатора р полимера обычно уменьшается. Наиболее изучены композиции на основе поливинилхлорида, например с пластификатором диоктилфталатом [11], с трикрезилфосфатом [12]. [c.8]
Сведения о полимерном строении цолучают, исследуя свойства растворов, 1Строение кристаллов, механические и физико-химические свойства неорганических полимеров. Структура нерастворимых полимеров, длина и углы связей, строение элементарной ячейки исследуются рентгенографическими и электронографическими методами. Неорганические вещества могут быть изоляторами, полупроводниками и проводниками электричества. Изучение электропроводности дает ценные сведения о их строении. Наблюдения за изменением теплоемкости и механических свойств полимеров в зависимости от температуры позволяют выяснить строение и свойства не только макромолекул, но иногда и надмолекулярных структур. [c.20]
Неорганические вещества могут быть изоляторами, полупроводниками и проводниками электричества. Изучение электропроводности дает ценные сведения о их строении. Наблюдения за изменением теплоемкости и механических свойств полимеров в зависимости от температуры позволяют выяснить строение и свойства не только макромолекул, но иногда и надмолекулярных структур. [c.20]
Изучение свойств растворов органических и неорганических веществ во фтористом водороде проводилось эбуллиоскопическим методом. Были изучены растворы бензоилфторида, фенилцианида, трихлоруксусной кислоты, фторида калия [39], уксусной кислоты, бензойной кислоты, ацетона, метил-этилкетона, диэтилкетона, ацетофенона, бензофенона, бензила, р-бензохи-нона и левулиновой кислоты [68]. Хотя повышение точки кипения и электропроводность растворов некоторых альдегидов и кетонов в HF [68] указывают на образование ионизирующих комплексных соединений с HF и на то, что в короткий промежуток времени эти комплексы заметно не разлагаются, все же численные значения этих величин не возрастают пропорционально концентрации. Это указывает на то, что реакция образования комплекса протекает очень медленно. [c.210]
Возможно, наиболее важным аспектом современной ионообменной хроматографии является применение систем автоматического детектирования, обеспечивающих непрерывную запись сигнала самописцем. Отсутствие подходящих детекторов для ионов, не поглощающих в ультрафиолетовой области спектра, по-видимому, сдерживало развитие автоматической ионообменной хроматографии, особенно для неорганических веществ. Однако в настоящее время превосходными датчиками для ионообменной хроматографии являются спектрофотометрические детекторн, в кoтopislx используется окрашиваю щий реагент, недавно созданные электрохимические детекторы и особенно детекторы электропроводности. [c.13]
Веществ, обладающих атомными решетками, сравнительно мапо. К ним принадлежат алмаз, кремний и некоторые неорганические соединения. Эти вещества характеризуются высокой твердостью (алмаз — самое твердое естественное вещество), они тугоплавки и нерастворимы практически ни в каких растворителях. Такие их свойства обусловлены прочностью ковалентной связи. Если атомы в кристаллической решетке связаны только проводит электрического тока и является изолятором (кварц). Если в атомной кристаллической решетке присутствуют делокализованные тг-связи, то вещество может иметь хорошую электропроводность (графит). Попытка сдвига одних участков кристаллической решетки относительно других приводит при достаточном усилии к ее разрушению, что связано с разрывом кова.пентных связей, обладающих направленностью. Количество ближайших частиц в кристаллической решетке, окружающих выбранную, назывгьется координационным числом. Координацрюн-ное число в атомных решетках определяется числом связей центрального с окружающими его атомами и, в силу насыщаемости ковалентной связи, не достигает больших значений. Часто оно равно четырем. [c.160]
Эти вещества характеризуются высокой твердостью (алмаз — самое твердое естественное вещество), они тугоплавки и нерастворимы практически ни в каких растворителях. Такие их свойства обусловлены прочностью ковалентной связи. Если атомы в кристаллической решетке связаны только проводит электрического тока и является изолятором (кварц). Если в атомной кристаллической решетке присутствуют делокализованные тг-связи, то вещество может иметь хорошую электропроводность (графит). Попытка сдвига одних участков кристаллической решетки относительно других приводит при достаточном усилии к ее разрушению, что связано с разрывом кова.пентных связей, обладающих направленностью. Количество ближайших частиц в кристаллической решетке, окружающих выбранную, назывгьется координационным числом. Координацрюн-ное число в атомных решетках определяется числом связей центрального с окружающими его атомами и, в силу насыщаемости ковалентной связи, не достигает больших значений. Часто оно равно четырем. [c.160]
Методы очистки воды с помощью ионообменных смол в настоящее время широко применяют как в лабораторных условиях, так и в промышленности. Ионообменные смолы — это нерастворимые высокомолекулярные вещества, которые имеют ионогенные группы гидроксила и гидроксония, способные к реакциям обмена с ионами, содержащимися в воде. Удалить диссоциированные в воде соединения можно фильтрованием воды либо последовательно через колонки с анионитом и катионитом, либо через смесь катионита и анионита (фильтр смешанного действия). Этим методом можно получить воду с очень низким значением удельной электропроводности. Обычно в деионизованной воде из неорганических примесей присутствуют только соли кремниевой кислоты или соединения железа в коллоидном состоянии. Однако в воде, очищенной на ионообменных смолах, содержатся примеси органических веществ, которые вымываются из ионитов (незаполимеризо-ванные мономеры, катализаторы синтеза и стабилизаторы высокомолекулярных соединений). В связи с этим деионизованная вода обычно не применяется при исследованиях строения границы между электродом и раствором, а также электрохимической кинетики. [c.27]
[c.27]
Обычно для фильтрования через сефадекс используют колонки с впаянным фильтром из пористого стекла, причем мертвое пространство под фильтром должно быть возможно меньшим. Наполнение колонки проводят так же, как при подготовке колонок для хроматографирования через иониты (см. гл. XX). Сефадекс наливают в колонку в виде суспензии и дают ему осесть. Вещество наносят в виде максимально концентрированного раствора, избегая взмучивание верхнего слоя сефадекса. Скорость вымывания может быть значительна по сравнению с ионитами, так как равновесие устанавливается очень быстро. Контроль фракций может быть осуществлен спектрофотометрически (для белков и нуклеиновых кислот) или измерением электропроводности (для неорганических солей). На рис. 222 изображен [c.204]
Практическое применение пиридина довольно разнообразно он служит растворителем, инсектицидом, исходным сырьем для синтеза различных детергентов, а также для синтеза антисептиков и некоторых других фармацевтических препаратов, например сульфидина, наконец, пиридин используется в производстве специальных красителей. В лабораторной практике его применяют в качестве специфического растворителя для многих органических веществ, трудно растворимых в других средах. Помимо того что пиридин растворяет большое число органических соединений, следует отметить, что безводный пиридин является хорошим растворителем для многих неорганических солей, в частности, бромида серебра, нитрата, серебра, хлоридов закисной и окисной меди, хлорида окисного железа, сулемы, нитрата свинца, ацетата свинца [5]. Такие растворы часто обладают значительной электропроводностью, и это обстоятельство особенно ценно для изучения электролитических свойств не растворимых в других средах соединений или гидролизуемых водой солей. Пиридин оказывает сильное каталитическое влияние на некоторые реакции. Превращение тростникового сахара в октаацетат при обработке его уксусным ангидридом ускоряется в присутствии пиридина [6]. Имеются указания о том, что ацетат пиридина катализирует реакции диенового синтеза [7]. Пиридин применяют при получении меркаптанов [8], атакже в качестве отрицательного катализатора при этерификации уксусной кислотой [9]. Ранее уже указывалось на применение пиридина в качестве связывающего кислоту вещества (стр. 318). [c.373]
Имеются указания о том, что ацетат пиридина катализирует реакции диенового синтеза [7]. Пиридин применяют при получении меркаптанов [8], атакже в качестве отрицательного катализатора при этерификации уксусной кислотой [9]. Ранее уже указывалось на применение пиридина в качестве связывающего кислоту вещества (стр. 318). [c.373]
Соединения, содержащие комбинированную (семиполярную) связь, занимают промежуточное положение в отношении летучести между соединениями, имеющими лишь ковалентные или электровалентные связи. Наиболее важные свойства, которые следует иметь в виду при делении молекул на электровалентные и ковалентные, следующие 1) электропроводность (для растворимых в воде соединений) 2) наличие или отсутствие стереоизомерии 3) степень летучести (электровалентные молекулы требуют затраты работы для отрыва их друг от друга и такие жидкости кипят при гораздо более высокой температуре, чем жидкости, образованные ковалентными соединениями) 4) растворимость в )лгле-водородных растворителях, т. е. нефтепродуктах или бензоле (неорганические соли нерастворимы, органические соединения растворимы) 5) тип упаковки молекул в твердом веществе (рентгеновский анализ кристаллов). Ионизация предполагает плотную упаковку (соли), в то время как ковалентные молекулы в кристаллическом состоянии имеют рыхлую структуру (MgO и СаО электро-валентны и имеют плотную структуру ВеО и aS ковалентны и обладают рыхлой структурой). [c.552]
Использование смешанных растворителей приводит к появлению двух общих проблем. Если происходит селективная сольватация [11, 181а], то константы ассоциации, полученные в двух разных средах, относятся к разным реакциям. Вероятно, если молярная доля воды больше, чем примерно 0,8, селективной сольватации комплексов металлов не происходит, так как вальденовское произведение предельной электропроводности и вязкости постоянно для ряда систем с большим содержанием воды [75, 148, 149]. В неводных средах ионы металлов и их комплексы не гидратируются и, вероятно, даже не сольватируются, и многие реакции ассоциации были изучены в безводных средах [86, 152, 199, 224, 257, 301]. Стандартное состояние для стехиометрических констант ассоциации выбирается для каждой конкретной среды (растворенные вещества плюс растворители). Предпринимались попытки элиминировать зависимость от концентрации электролита (вторичный эффект среды по Оуэну [123]), с тем чтобы относить стандартное состояние только к смеси растворителей [62, 75, 148, 149], но эти попытки вызывают возражения, изложенные в разделе II, 1, А. За исключением, возможно, амминов металлов, константы ассоциации большого числа разнообразных комплексов металлов, содержащих неорганические [284] и органические [283] лиганды, возрастают при уменьшении диэлектрической проницаемости среды. Это изменение происходит в направлении, ожидаемом на основании электростатических соображений, но влияние органических растворителей (первичный эффект среды по Оуэну [123]) на константы ассоциации не проанализировано. [c.69]
Стандартное состояние для стехиометрических констант ассоциации выбирается для каждой конкретной среды (растворенные вещества плюс растворители). Предпринимались попытки элиминировать зависимость от концентрации электролита (вторичный эффект среды по Оуэну [123]), с тем чтобы относить стандартное состояние только к смеси растворителей [62, 75, 148, 149], но эти попытки вызывают возражения, изложенные в разделе II, 1, А. За исключением, возможно, амминов металлов, константы ассоциации большого числа разнообразных комплексов металлов, содержащих неорганические [284] и органические [283] лиганды, возрастают при уменьшении диэлектрической проницаемости среды. Это изменение происходит в направлении, ожидаемом на основании электростатических соображений, но влияние органических растворителей (первичный эффект среды по Оуэну [123]) на константы ассоциации не проанализировано. [c.69]
Растворы в жидком аммиаке веществ, перечисленных в табл. 46, проводят электрический ток, так как эти кислоты ионизированы. Ограничимся ссылками на работы, в которых измерена электропроводность многочисленных кислот в жидком аммиаке 1 (аммонийные соли, амиды неорганических кислот, производные бензол-сульфамида и карбаминовой кислоты, алифатические нитросоединения, производные фенола и анилина, азотистые гетероциклы, ацетилен). [c.270]
2. Какие из перечисленных ниже жидкостей проводят электрический ток: а 100-процентная серная кислота; б водный раствор азотной кислоты; в раствор азота в воде? Ответ б 3
Ахметов М. А. Подготовка к ЕГЭ по химии 2008
ГОТОВИМСЯ К ЕГЭ по ХИМИИ http://maratakm.narod.ru
АХМЕТОВ М. А. УРОК 28. Ответы
Диссоциация электролитов в водных растворах. Слабые и сильные электролиты. Реакции ионного обмена.
1. Какие из перечисленных ниже жидкостей проводят электрический ток: а) спирт; б) водный раствор поваренной соли; в) дистиллированная вода; г) водный раствор сахара?
Ответ б)
2. Какие из
перечисленных ниже жидкостей проводят
электрический ток: а) 100-процентная
серная кислота; б) водный раствор азотной
кислоты; в) раствор азота в воде?
Какие из
перечисленных ниже жидкостей проводят
электрический ток: а) 100-процентная
серная кислота; б) водный раствор азотной
кислоты; в) раствор азота в воде?
Ответ б)
3. Безводный жидкий фтороводород не проводит тока, а водный раствор его ток проводит. Чем это можно объяснить?
Ответ HFH++F—
4. Почему соляную кислоту приходится хранить не в стальных, а в стеклянных или керамических сосудах, между тем как для безводной серной кислоты пригодны железные контейнеры?
Безводная серная кислота не реагирует с железом
5. Раствор хлороводорода в бензоле не проводит электрического тока и не действует на цинк. Чем это можно объяснить?
Хлороводород не диссоциирует в соляной кислоте
6. Какие ионы содержатся в водных растворах: а) нитрата калия; б) хлорида кальция; в) сульфата натрия?
а) K++ NO3— б) Ca2++ Cl— в) Na++ SO42-
7. Как называются и чем отличаются между собой частицы, изображенные символами: а) Сl-, С1, С12; б) S03, S032-; в) Na, Na+; г) S, S2-?
Отличаются числом электронов. Каждый отрицательный заряд означает наличие дополнительного электрона.
а) К примеру, у хлора их 17, а у Cl— — 18, у молекулы хлора – 34 электрона
б) У S03 – 16+8*3=40 электронов, а у S032- — 42.
в) У Na – 11 электронов, а Na+ — 10
г) у S – 16 электронов, а у S2- — 18 электронов.
8. Можно ли
приготовить водный раствор, который в
качестве растворенного вещества
содержал бы только: a)
S03;
б) S042-;
в) Na;
г) Na+;
д) С1—; е) С12;
ж) Са2+? Ответ
поясните.
а) S03 – нет S03 реагирует с водой. S03+Н2O=H2SO4
б) S042- — нет, нужны еще и катионы
в) нет – нужны еще и анионы
г) да – хлор реагирует с водой, но эта реакция обратима Сl2+H2OHCl+HClO
д) нет, нужны еще и катионы
9. Можно ли приготовить раствор, содержащий в растворенном виде только: а) серу; б) ион S2-; в) фосфор; г) ион Р3-; д) азот; е) ион Na+? Дайте обоснованный ответ.
10. Какие ионы содержатся в водных растворах: а) бромида калия; б) едкого кали; в) азотной кислоты; г) фторида натрия?
а) KBr=K++Br—
б) KOH=K++OH—
в) HNO3=H++NO3—
г) NaF=Na++F—
11. Какие ионы содержатся в водных растворах: а) нитрата алюминия; б) сульфата алюминия; в) иодоводорода?
а) NaNO3=Na++NO3—
б) Al2(SO4)3=2Al3++SO42-
в) HI=H++I—
12. Напишите и прочитайте уравнения электролитической диссоциации в водных растворах следующих веществ: а) сульфата калия; б) хлорида кальция; в) бромоводорода.
а) К2SO4=K++SO42-
б) CaCl2=Ca2++2Cl—
в) HBr=H++Br—
13. Напишите
и прочитайте уравнения электролитической
диссоциации в водных растворах следующих
веществ: а) нитрата цинка; б) хлорида
бария; в) бромида калия.
Напишите
и прочитайте уравнения электролитической
диссоциации в водных растворах следующих
веществ: а) нитрата цинка; б) хлорида
бария; в) бромида калия.
14. Изобразите при помощи уравнений электролитическую диссоциацию веществ, формулы которых Ва (ОН)2, К3Р04, КС103, КС1, NaHS04. Прочитайте написанные уравнения.
15. Составьте уравнения электролитической диссоциации: а) сульфата меди; б) хлорида кальция; в) гидроксида натрия. Прочитайте уравнения.
16. Составьте уравнения электролитической диссоциации:
а) сульфата серебра; б) гидроксида кальция; в) соляной кислоты. Прочитайте уравнения.
17. Напишите уравнения электролитической диссоциации веществ, формулы которых: a) FeCl3; б) FeCl2; в) растворимого минерала карналлита KCl-MgCl2. Прочитайте уравнения.
в) KCl—MgCl2=K++Mg2++3Cl—
18. Изобразите уравнениями последовательные ступени электролитической диссоциации: а) мышьяковой кислоты H3As04; б) сероводорода в водном растворе.
а)
H3SO4=H++H2AsO4—
H2AsO4—=H++HAsO42-
HAsO42-=H++AsO43-
19. Изобразите уравнениями последовательные ступени диссоциации угольной кислоты.
20. Изобразите уравнениями
последовательные ступени диссоциации
сернистой кислоты H2S03.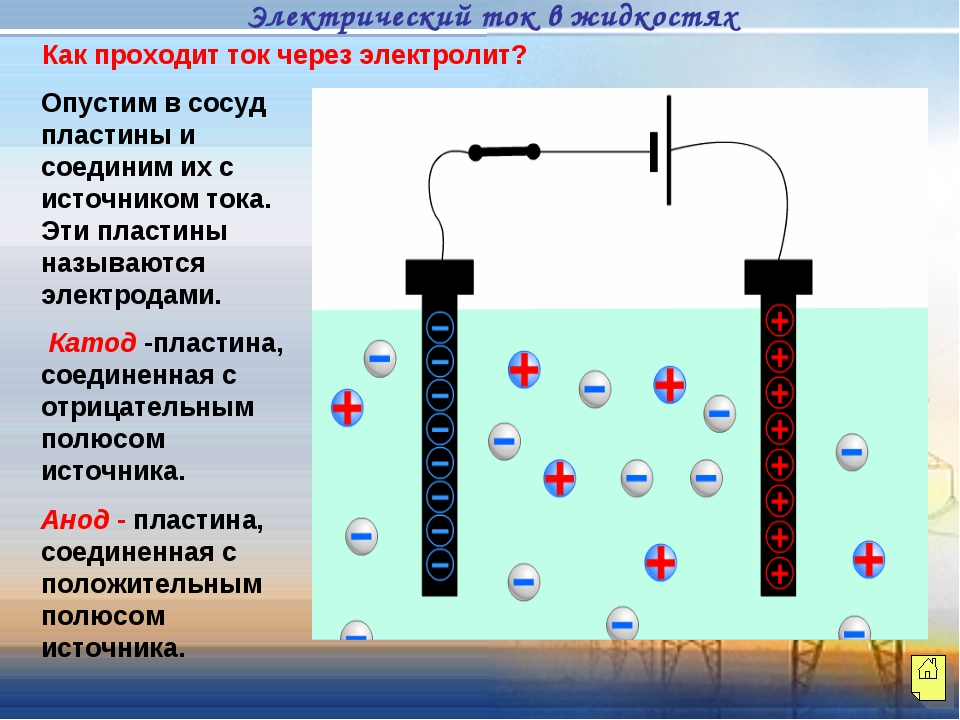
21. Изобразите уравнениями последовательные стадии диссоциации селеновой кислоты H2Se04.
22. Как практически осуществить процессы, выражающиеся следующими уравнениями:
а) НС1Н+ + С1
б) Cu + Cl2CuCl2
в) Си2+ + 20Н— Си (ОН)2
в) СuSO4+2NaOH=Cu(OH)2+Na2SO4
23. Как практически осуществить реакции, схематически изображаемые уравнениями:
1) H2S042H+ + SO42- — растворить в воде
2) H+OH—H20 провести реакцию кислоты со щелочью
3) Mg (OH)2 Mg2+ + 20Н- — реакция практически не осуществима
24. Как практически осуществить реакцию, представленную уравнением:
2Na + С12 = 2NaCl
опустить натрий в стакан с хлором
25. Опишите подробно опыты, иллюстрирующие следующие превращения:
1) Mg + Pb2+Mg2+ + Pb магний опустили в раствор нитрата свинца
2) Си + 2Ag+ Cu2+ + 2Ag медь опустили в нитрата серебра
3) Hg + 2Ag+Hg2+ + 2Ag ртуть опустили в раствор нитрата серебра
26. На сколько ионов распадается при полной диссоциации молекула каждого из электролитов, формулы которых: a) H2S04; б) Sr (OH)2; в) Н3Р04?
а) 3 б) 3 в) 4
27. Как практически осуществить реакцию, сначала представленную уравнением 1, а затем уравнением 2:
1) Са(ОН)2Са2+ + 20Н— растворить вещество в воде
2) Са2+ + 20Н— Са(ОН)2 к раствору хлорида кальция добавить гидроксид натрия
28. Напишите формулы
веществ, которые при растворении
в воде диссоциируют на ионы: а) Ва2+ и ОН2- ; б)
Са2+ и N03—.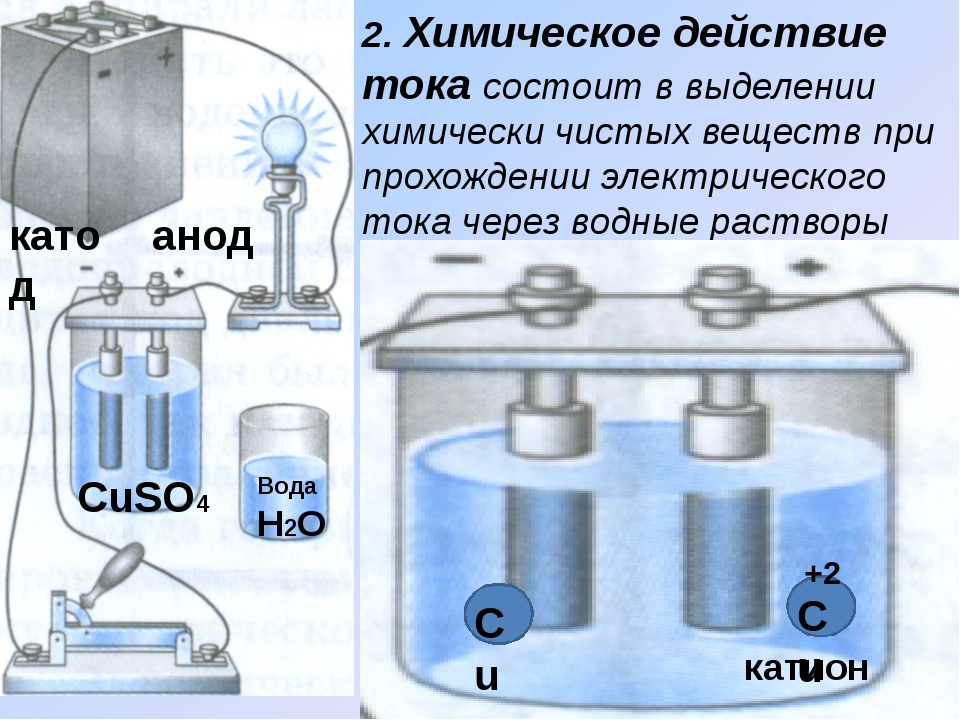
Ba(OH)2 Ca(NO3)2
29. Напишите формулы веществ, диссоциирующих в воде на ионы: а) А13+ и S042-; б) Mg2+ и Мn042-.
30. Напишите формулы веществ, диссоциирующих в воде на ионы: а) К+ и Сг042-; б) Fe2+ и N03—; в) Fe3+ и N03—.
31. В воде одного источника были обнаружены следующие ионы: Na+, K+, Fe2+, Ca2+, Mg2+2Cl—, Br— , S042- Растворением каких солей в дистиллированной воде можно получить раствор, содержащий те же ионы? Имеет ли задача только одно решение? Ответ поясните.
KCl, MgCl2 Na2SO4, FeBr2,CaCl2 или KBr+MgSO4+NaCl+FeCl2+CaBr2
32. Какие из перечисленных ниже веществ при электролитической диссоциации образуют ионы хлора: а) хлорид калия;
б) бертолетова соль КС103; в) перхлорат калия КС104; г) нашатырь NH4C1? При помощи какого раствора можно доказать присутствие ионов хлора в растворах указанных вами солей?
хлорид калия и хлорид аммония. Можно доказать добавлением раствора нитрата серебра
33. Раствор хлорида калия бесцветен, а раствор марганцовокислого калия КМп04 окрашен в фиолетово-красный цвет. Каким ионом вызвана окраска раствора соли КМп04?
MnO4 —
34. К какому классу относится вещество, если его водный раствор хорошо проводит электрический ток и не окрашивает фиолетового лакмуса ни в красный, ни в синий цвет?
это соль
35. Хлорид
меди СuС12 ядовит. С каким ионом связана токсичность
этой соли?
Хлорид
меди СuС12 ядовит. С каким ионом связана токсичность
этой соли?
Cu2+
36. Напишите формулы: а) четырех бесцветных катионов; б) четырех бесцветных анионов; .в) известных вам окрашенных катионов.
а) K+ Na+ Mg2+ Li+
б) Cl— SO42- NO3— OH—
в) Сu2+ Ni2+
37. Почему раствор иодида калия, хотя и содержит иод, не окрашивает крахмал в синий цвет?
I2 и KI – разные вещества
38. Каковы различия в свойствах между атомом водорода и ионом водорода?
ион водорода обладает окислительными свойствами, а молекула водорода чаще всего восстановитель. катион водорода обычно существует в водных растворах, а водород бесцветный газ
39. Придают ли окраску раствору: а) ионы кальция; б) ионы меди; в) анионы серной кислоты; г) анионы азотной кислоты; д) ионы серебра?
окрашены только к ионы меди
40. Придают ли окраску раствору: а) ионы иода; б) ионы брома; в) ионы калия; г) ионы С032~?
нет
41. Растворы некоторых солей соляной кислоты имеют окраску. Катионы или анионы придают цвет этим солям? Приведите примеры.
CuCl2 – синезеленый цвет
42. Растворы некоторых солей натрия имеют окраску. Чем она обусловлена — катионами или анионами? Из чего вы это заключаете?
анионами, так как катион не окрашен
43. Растворы хлорида бария
и мышьяковой кислоты H3As04 ядовиты. Какими ионами
обусловлена ядовитость каждого из этих
соединений?
Растворы хлорида бария
и мышьяковой кислоты H3As04 ядовиты. Какими ионами
обусловлена ядовитость каждого из этих
соединений?
As042-
44. Выпишите названия известных вам минеральных удобрений и формулы анионов и катионов, заключающих в себе питательный элемент.
Ca(H2PO4)2. NH4H2PO4 (NH4)2HPO4. CaHPO4·2H2O NH4NO3 (NH4)2SO4, NH4Cl, (NH4)2CO3 NH4HCO3 (NH4)2S mKCl + nNaCl
45. Во всех ли случаях растворение вещества сопровождается возникновением ионов? Ответ мотивируйте, приведя примеры.
нет, например сахар
46. Зная число молей в 1 л воды и что число ионов водорода в этом объеме воды равно 6,02-1018, найдите, сколько молекул воды приходится на одну молекулу воды, распавшейся на ионы.
10 миллионов
47. В лаборатории имеется 98-процентная серная кислота. Как правильно называть такую кислоту — концентрированная или сильная кислота?
концентрированная она не диссоциирована на ионы
48. От каких факторов зависит степень диссоциации электролита в водном растворе? Ответ поясните примерами.
от природы электролита и концентрации
чем концентрация ниже, тем степень диссоциации выше
49. Как влияет повышение концентрации электролита в растворе на степень диссоциации?
чем концентрация ниже, тем степень диссоциации выше
50. Как влияет температура на степень диссоциации?
с температурой увеличивается
51. Приведите примеры сильных, средних и слабых электролитов.
HCl – сильный
H3PO4 – средний
H2S – слабый
52. Имеется 1 л раствора,
содержащего 1 моль нитрата калия.
Степень диссоциации соли в этом растворе
равна 70%. Сколько граммов электролита
диссоциировано на ионы?
Имеется 1 л раствора,
содержащего 1 моль нитрата калия.
Степень диссоциации соли в этом растворе
равна 70%. Сколько граммов электролита
диссоциировано на ионы?
70,7
53. Считая, что степень диссоциации соляной кислоты в растворе, содержащем 0,1 моль в 1 л, равна 90%, найдите, сколько граммов водорода находится в виде ионов в 2 л кислоты.
6,57 г
54. В растворе уксусной кислоты содержится е виде ионов 0,001 г водорода и 0,1 моль недиссоциированкой кислоты. Какова степень диссоциации уксусной кислоты в этом растворе?
1%
55. Производились исследования с раствором, в 1 л которого содержалось по 1 моль бромида натрия и сульфата калия. Как приготовить раствор в точности такого же количественного состава, если вместо бремида натрия взять бромид калия?
56. В литре раствора содержится 1 моль нитрата калия и 1 моль хлорида натрия. Из каких двух других солей и как можно приготовить раствор точно такого количественного состава?
57. В 1 л раствора содержится 2 моль хлорида натрия и 1 моль серной кислоты. Из каких двух веществ и как можно приготовить раствор точно такого же состава?
58. Средняя концентрация солей в морской воде выражается следующими числами (по массе): хлорид натрия — 2,91%, сульфат кальция — 0,13%, хлорид магния — 0,41%, сульфат калия — 0,09%, сульфат магния — 0,18%. Каких катионов больше всего в морской воде?
59. При применении цинка в качестве микроудобрения его вносят из расчета 15—20 кг сульфата цинка ZnS04-7H20 на гектар. Сколько это составляет в пересчете на ионы Zn2+?
60. Для предпосевной обработки семян применяется раствор, содержащий 0,02% медного купороса. Вычислите, сколько (в процентах) это составляет в пересчете на ион Cu2+.
61. В каких количественных отношениях нужно взять массу хлорида калия и массу сульфата калия, чтобы получить растворы с одинаковым содержанием ионов К+?
62. В каких
количественных отношениях нужно взять
массу сульфата магния и массу сульфата
алюминия, чтобы получить растворы с
одинаковым содержанием ионов SO2-?
В каких
количественных отношениях нужно взять
массу сульфата магния и массу сульфата
алюминия, чтобы получить растворы с
одинаковым содержанием ионов SO2-?
63. Анализом было установлено, что раствор содержит 0,69 г/л Na+ и 1,86 г/л N03—. Одинаковое или разное количество этих двух видов ионов содержится в указанном растворе?
64. Анализом было найдено, что в 1 л раствора сульфата натрия содержится 0,1 моль ионов S042-. Сколько граммов ионов Na+ содержится в литре этого раствора?
65. Анализом было найдено, что в 1 л раствора, полученного растворением смеси бромида калия и бромида натрия, содержится 3 моль ионов Вг~ и 1 моль ионов К+. Сколько граммов ионов Na+ было в этом растворе?
66. Какое вещество, состоящее из двух элементов, подходит одновременно под определения кислоты и основания?
67 Какие из веществ, формулы которых КОН, НС103, НСlO4, KHS04, H20, образуют при диссоциации ионы водорода и гидроксида? Напишите соответствующие уравнения реакций.
68. Что представляют собой ионы водорода с точки зрения теории строения атомов? Как их открывают в водном растворе?
69. Изобразите электронную схему строения иона гидроксида (так, как ранее изображались электронные схемы строения молекулы воды и пр.). Как можно обнаружить ионы гидроксида в водном растворе?
70. Какие из соединений: аммиак, сероводород, фосфин, селеноводород — при растворении в воде способны присоединять протоны и какие их отщепляют?
амимак и фосфин присоединяют, сероводород и селеноводород отщепляют
71. Как меняется сила бескислородных кислот в зависимости от радиуса аниона?
с возрастанием радиуса увеличивается сила
72. Как зависит сила бескислородной кислоты от заряда аниона?
уменьшается
73. От каких факторов зависит сила кислородсодержащих кислот?
от числа атомов кислорода и электроотрицательности кислотообразующего элемента
74. Из трех кислот, формулы
которых НС103;
HN03;
HBr03,
укажите самую сильную и самую слабую.
Ответ мотивируйте.
Из трех кислот, формулы
которых НС103;
HN03;
HBr03,
укажите самую сильную и самую слабую.
Ответ мотивируйте.
HN03– самая сильная
HBr03 – самая слабая
75. Какая из кислот, формулы которых H2C03; H2Si03 и •H2S03, самая сильная и почему? Ответ поясните.
H2S03 –самая сильная
H2Si03 – самая слабая
76. От каких факторов зависит степень диссоциации оснований? Ответ поясните примерами.
От степени полярности связи металл-кислород, а также от заряда катиона металла
77. Какое из оснований: Са(ОН)2; Mg(OH)2; NaOH; Ba(OH)2— самое сильное и какое самое слабое? Ответ мотивируйте.
NaOH – самое сильное
Mg(OH)2 – самое слабое
78. Из четырех оснований: Ва(ОН)2; Sr(OH)2; Ca(OH)3; Mg(OH)2 — укажите самое сильное основание. Объясните почему.
79. Какое из оснований самое сильное и какое самое слабое: RbOH; NaOH; КОН или LiOH? Ответ поясните.
80. Какое из пяти оснований самое сильное: А1(ОН)3; Са(ОН)2; Mg(OH)2; NaOH; КОН? Дайте мотивированный ответ.
81. В литре воды растворены 1 моль хлорида калия и 1 моль-иодида натрия. Из каких двух других солей и как можно приготовить раствор точно такого же состава?
1 моль иодида калия 1 моль хлорида натрия.
82. В литре воды растворены 2 моль бромида калия и 1 моль сульфида натрия. Из каких двух других солей и как можно приготовить раствор точно такого же состава?
83. В литре воды растворены 1 моль сульфата магния и 2 моль хлорида натрия. Из каких двух других солей может быть приготовлен раствор точно такого же состава и какое количество каждой из них нужно для этого взять?
84. Укажите известные вам
способы превращения атомов меди в ионы
меди и ионов меди в атомы меди. Приведите
соответствующие уравнения реакций.
Приведите
соответствующие уравнения реакций.
Сu+Cl2=CuCl2
CuO+H2=Cu+H2O
85. Какие ионы могут присутствовать в растворе, если при введении ионов S042- выпадает осадок, а при введении ионов Сl образование осадка не наблюдается?
ионы бария
86. Напишите ионные уравнения реакций между растворенными в воде: а) гашеной известью и азотной кислотой; б) азотной кислотой и гидроксидом калия; в) серной кислотой и гидроксидом лития.
в) 2H++SO42-+2K++2OH—= SO42-+2K++2H2O
87. Напишите ионные уравнения реакций между растворенными в воде: a) H2Se04 (сильная кислота) и КОН; б) НС104 (сильная кислота) и NaOH.
88. Напишите ионные уравнения реакций между растворенными в воде: а) сульфатом меди и гидроксидом лития; б) хлоридом меди (II) и гидроксидом калия.
89. Напишите ионные уравнения реакций между растворенными в воде: а) сульфатом железа (II) и гидроксидом лития, б) сульфатом железа (III) и гидроксидом натрия.
90. Напишите ионные уравнения реакций между растворенными в воде: а) нитратом магния и едким натром; б) сернокислым магнием и гидроксидом лития; в) хлоридом магния и гидроксидом кальция.
91. Напишите ионные уравнения реакций между растворенными в воде: а) сульфатом меди и хлоридом бария; б) сульфатом алюминия и хлоридом бария; в) сульфатом натрия и нитратом бария.
93. Напишите ионные уравнения реакций между растворами следующих солей: а) нитратом серебра и бромидом натрия; б) нитратом серебра и бромидом кальция; в) нитратом серебра и бромидом меди (II).
93. Напишите ионные уравнения реакций (в полной и сокращенной форме) между: а) нитратом серебра и иодидом магния; б) сульфатом серебра и иодидом лития; в) нитратом серебра и иодидом бария в растворе.
94. Напишите в ионной форме уравнения реакций, представленных следующими схемами:
1) Са (N03)2+ К2С03 → СаС03 + KN03
2) Ag2S04 + K3P04 → Ag3P04 + K2S04
3) HN03 + Ba (OH)3 → Ba (N03)„ + H20
95. Напишите в полной и
сокращенной ионной форме уравнения
реакций, представленных следующими
схемами:
Напишите в полной и
сокращенной ионной форме уравнения
реакций, представленных следующими
схемами:
1) Ba (N03)2 + H2S04 → DaS04 + HN03
2) Ag2S04 + BaCl2 .. → BaS04 + AgCl
3) H2S04 + Sr (OH)2 .. → SrS04 + H20
96. Напишите в полной и сокращенной ионной форме уравнения реакций, представленных следующими схемами:
1) ВаС12 + Na2Se04 .. → BaSe04 + NaCl
2) Ag2S04 + А1С1а .. → AgCl + Al2 (S04)3
3) Na2Si03 + Ba (OH)2 -> BaSi03 + NaOH
97. Напишите в ионной форме уравнения реакций, представленных следующими схемами:
а) Fe(ОН), + HN03 .. → Fe(N03)2 + H20
б) Fe(OH)3 + H2S04 .. → Fe2(S04)3 + Н20
98. Напишите ионные уравнения реакций, происходящих при попарном сливании растворов солей, формулы которых Ag2S04, ВаС12, Pb(N03)2, Na3P04.
99. В банку был налит раствор гидроксида бария. Из бюретки по каплям прибавляли раствор серной кислоты. По мере прибавления серной кислоты лампа светила все более тускло. Через некоторое время лампа совсем погасла. Почему гаснет лампа? Что будет наблюдаться при дальнейшем прибавлении кислоты? Будут ли наблюдаться те же явления, если серную кислоту заменить соляной?
Лампа гаснет, потому что уменьшается количество ионов. При добавлении избытка серной кислоты лампа будет гореть все более интенсивно
Мужчина облил себя бензином в офисе «Яндекс.
 Такси» в Москве и угрожал самосожжением — его задержали Статьи редакции
Такси» в Москве и угрожал самосожжением — его задержали Статьи редакции {«id»:171628,»url»:»https:\/\/vc.ru\/transport\/171628-muzhchina-oblil-sebya-benzinom-v-ofise-yandeks-taksi-v-moskve-i-ugrozhal-samosozhzheniem-ego-zaderzhali»,»title»:»\u041c\u0443\u0436\u0447\u0438\u043d\u0430 \u043e\u0431\u043b\u0438\u043b \u0441\u0435\u0431\u044f \u0431\u0435\u043d\u0437\u0438\u043d\u043e\u043c \u0432 \u043e\u0444\u0438\u0441\u0435 \u00ab\u042f\u043d\u0434\u0435\u043a\u0441.\u0422\u0430\u043a\u0441\u0438\u00bb \u0432 \u041c\u043e\u0441\u043a\u0432\u0435 \u0438 \u0443\u0433\u0440\u043e\u0436\u0430\u043b \u0441\u0430\u043c\u043e\u0441\u043e\u0436\u0436\u0435\u043d\u0438\u0435\u043c \u2014 \u0435\u0433\u043e \u0437\u0430\u0434\u0435\u0440\u0436\u0430\u043b\u0438″,»services»:{«facebook»:{«url»:»https:\/\/www.facebook.com\/sharer\/sharer.php?u=https:\/\/vc.ru\/transport\/171628-muzhchina-oblil-sebya-benzinom-v-ofise-yandeks-taksi-v-moskve-i-ugrozhal-samosozhzheniem-ego-zaderzhali»,»short_name»:»FB»,»title»:»Facebook»,»width»:600,»height»:450},»vkontakte»:{«url»:»https:\/\/vk.com\/share.php?url=https:\/\/vc.ru\/transport\/171628-muzhchina-oblil-sebya-benzinom-v-ofise-yandeks-taksi-v-moskve-i-ugrozhal-samosozhzheniem-ego-zaderzhali&title=\u041c\u0443\u0436\u0447\u0438\u043d\u0430 \u043e\u0431\u043b\u0438\u043b \u0441\u0435\u0431\u044f \u0431\u0435\u043d\u0437\u0438\u043d\u043e\u043c \u0432 \u043e\u0444\u0438\u0441\u0435 \u00ab\u042f\u043d\u0434\u0435\u043a\u0441.\u0422\u0430\u043a\u0441\u0438\u00bb \u0432 \u041c\u043e\u0441\u043a\u0432\u0435 \u0438 \u0443\u0433\u0440\u043e\u0436\u0430\u043b \u0441\u0430\u043c\u043e\u0441\u043e\u0436\u0436\u0435\u043d\u0438\u0435\u043c \u2014 \u0435\u0433\u043e \u0437\u0430\u0434\u0435\u0440\u0436\u0430\u043b\u0438″,»short_name»:»VK»,»title»:»\u0412\u041a\u043e\u043d\u0442\u0430\u043a\u0442\u0435″,»width»:600,»height»:450},»twitter»:{«url»:»https:\/\/twitter.com\/intent\/tweet?url=https:\/\/vc.ru\/transport\/171628-muzhchina-oblil-sebya-benzinom-v-ofise-yandeks-taksi-v-moskve-i-ugrozhal-samosozhzheniem-ego-zaderzhali&text=\u041c\u0443\u0436\u0447\u0438\u043d\u0430 \u043e\u0431\u043b\u0438\u043b \u0441\u0435\u0431\u044f \u0431\u0435\u043d\u0437\u0438\u043d\u043e\u043c \u0432 \u043e\u0444\u0438\u0441\u0435 \u00ab\u042f\u043d\u0434\u0435\u043a\u0441. \u0422\u0430\u043a\u0441\u0438\u00bb \u0432 \u041c\u043e\u0441\u043a\u0432\u0435 \u0438 \u0443\u0433\u0440\u043e\u0436\u0430\u043b \u0441\u0430\u043c\u043e\u0441\u043e\u0436\u0436\u0435\u043d\u0438\u0435\u043c \u2014 \u0435\u0433\u043e \u0437\u0430\u0434\u0435\u0440\u0436\u0430\u043b\u0438″,»short_name»:»TW»,»title»:»Twitter»,»width»:600,»height»:450},»telegram»:{«url»:»tg:\/\/msg_url?url=https:\/\/vc.ru\/transport\/171628-muzhchina-oblil-sebya-benzinom-v-ofise-yandeks-taksi-v-moskve-i-ugrozhal-samosozhzheniem-ego-zaderzhali&text=\u041c\u0443\u0436\u0447\u0438\u043d\u0430 \u043e\u0431\u043b\u0438\u043b \u0441\u0435\u0431\u044f \u0431\u0435\u043d\u0437\u0438\u043d\u043e\u043c \u0432 \u043e\u0444\u0438\u0441\u0435 \u00ab\u042f\u043d\u0434\u0435\u043a\u0441.\u0422\u0430\u043a\u0441\u0438\u00bb \u0432 \u041c\u043e\u0441\u043a\u0432\u0435 \u0438 \u0443\u0433\u0440\u043e\u0436\u0430\u043b \u0441\u0430\u043c\u043e\u0441\u043e\u0436\u0436\u0435\u043d\u0438\u0435\u043c \u2014 \u0435\u0433\u043e \u0437\u0430\u0434\u0435\u0440\u0436\u0430\u043b\u0438″,»short_name»:»TG»,»title»:»Telegram»,»width»:600,»height»:450},»odnoklassniki»:{«url»:»http:\/\/connect.ok.ru\/dk?st.cmd=WidgetSharePreview&service=odnoklassniki&st.shareUrl=https:\/\/vc.ru\/transport\/171628-muzhchina-oblil-sebya-benzinom-v-ofise-yandeks-taksi-v-moskve-i-ugrozhal-samosozhzheniem-ego-zaderzhali»,»short_name»:»OK»,»title»:»\u041e\u0434\u043d\u043e\u043a\u043b\u0430\u0441\u0441\u043d\u0438\u043a\u0438″,»width»:600,»height»:450},»email»:{«url»:»mailto:?subject=\u041c\u0443\u0436\u0447\u0438\u043d\u0430 \u043e\u0431\u043b\u0438\u043b \u0441\u0435\u0431\u044f \u0431\u0435\u043d\u0437\u0438\u043d\u043e\u043c \u0432 \u043e\u0444\u0438\u0441\u0435 \u00ab\u042f\u043d\u0434\u0435\u043a\u0441.\u0422\u0430\u043a\u0441\u0438\u00bb \u0432 \u041c\u043e\u0441\u043a\u0432\u0435 \u0438 \u0443\u0433\u0440\u043e\u0436\u0430\u043b \u0441\u0430\u043c\u043e\u0441\u043e\u0436\u0436\u0435\u043d\u0438\u0435\u043c \u2014 \u0435\u0433\u043e \u0437\u0430\u0434\u0435\u0440\u0436\u0430\u043b\u0438&body=https:\/\/vc.
\u0422\u0430\u043a\u0441\u0438\u00bb \u0432 \u041c\u043e\u0441\u043a\u0432\u0435 \u0438 \u0443\u0433\u0440\u043e\u0436\u0430\u043b \u0441\u0430\u043c\u043e\u0441\u043e\u0436\u0436\u0435\u043d\u0438\u0435\u043c \u2014 \u0435\u0433\u043e \u0437\u0430\u0434\u0435\u0440\u0436\u0430\u043b\u0438″,»short_name»:»TW»,»title»:»Twitter»,»width»:600,»height»:450},»telegram»:{«url»:»tg:\/\/msg_url?url=https:\/\/vc.ru\/transport\/171628-muzhchina-oblil-sebya-benzinom-v-ofise-yandeks-taksi-v-moskve-i-ugrozhal-samosozhzheniem-ego-zaderzhali&text=\u041c\u0443\u0436\u0447\u0438\u043d\u0430 \u043e\u0431\u043b\u0438\u043b \u0441\u0435\u0431\u044f \u0431\u0435\u043d\u0437\u0438\u043d\u043e\u043c \u0432 \u043e\u0444\u0438\u0441\u0435 \u00ab\u042f\u043d\u0434\u0435\u043a\u0441.\u0422\u0430\u043a\u0441\u0438\u00bb \u0432 \u041c\u043e\u0441\u043a\u0432\u0435 \u0438 \u0443\u0433\u0440\u043e\u0436\u0430\u043b \u0441\u0430\u043c\u043e\u0441\u043e\u0436\u0436\u0435\u043d\u0438\u0435\u043c \u2014 \u0435\u0433\u043e \u0437\u0430\u0434\u0435\u0440\u0436\u0430\u043b\u0438″,»short_name»:»TG»,»title»:»Telegram»,»width»:600,»height»:450},»odnoklassniki»:{«url»:»http:\/\/connect.ok.ru\/dk?st.cmd=WidgetSharePreview&service=odnoklassniki&st.shareUrl=https:\/\/vc.ru\/transport\/171628-muzhchina-oblil-sebya-benzinom-v-ofise-yandeks-taksi-v-moskve-i-ugrozhal-samosozhzheniem-ego-zaderzhali»,»short_name»:»OK»,»title»:»\u041e\u0434\u043d\u043e\u043a\u043b\u0430\u0441\u0441\u043d\u0438\u043a\u0438″,»width»:600,»height»:450},»email»:{«url»:»mailto:?subject=\u041c\u0443\u0436\u0447\u0438\u043d\u0430 \u043e\u0431\u043b\u0438\u043b \u0441\u0435\u0431\u044f \u0431\u0435\u043d\u0437\u0438\u043d\u043e\u043c \u0432 \u043e\u0444\u0438\u0441\u0435 \u00ab\u042f\u043d\u0434\u0435\u043a\u0441.\u0422\u0430\u043a\u0441\u0438\u00bb \u0432 \u041c\u043e\u0441\u043a\u0432\u0435 \u0438 \u0443\u0433\u0440\u043e\u0436\u0430\u043b \u0441\u0430\u043c\u043e\u0441\u043e\u0436\u0436\u0435\u043d\u0438\u0435\u043c \u2014 \u0435\u0433\u043e \u0437\u0430\u0434\u0435\u0440\u0436\u0430\u043b\u0438&body=https:\/\/vc. ru\/transport\/171628-muzhchina-oblil-sebya-benzinom-v-ofise-yandeks-taksi-v-moskve-i-ugrozhal-samosozhzheniem-ego-zaderzhali»,»short_name»:»Email»,»title»:»\u041e\u0442\u043f\u0440\u0430\u0432\u0438\u0442\u044c \u043d\u0430 \u043f\u043e\u0447\u0442\u0443″,»width»:600,»height»:450}},»isFavorited»:false}
ru\/transport\/171628-muzhchina-oblil-sebya-benzinom-v-ofise-yandeks-taksi-v-moskve-i-ugrozhal-samosozhzheniem-ego-zaderzhali»,»short_name»:»Email»,»title»:»\u041e\u0442\u043f\u0440\u0430\u0432\u0438\u0442\u044c \u043d\u0430 \u043f\u043e\u0447\u0442\u0443″,»width»:600,»height»:450}},»isFavorited»:false}
11 835 просмотров
Электропроводность дизельного топлива
Электропроводность топлива рассчитывается исходя из способности топлива рассеивать статический электрический заряд. Дизельное топливо — это углеводород. Дизельное топливо — это комбинация углеводородов, полученных перегонкой сырой нефти. Это непроводник. Этот зонд зависит от того факта, что вода тяжелее дизельного топлива, поэтому дизельное топливо плавает.
Значение электропроводности около 50 пс требуется, чтобы дизельное топливо не создавало статического разряда при быстром движении, а прямогонное дизельное топливо могло бы иметь такое высокое или большее значение.Дизельное топливо со сверхнизким содержанием серы (ULSD) стало нормой во многих странах примерно с 2006 года, и процессы, связанные с удалением серы, имеют тенденцию к снижению проводимости. Очень интересные сравнения сделаны в ссылке, в которой конкретное дизельное топливо «до 2006 года» сравнивается с ULSD с точки зрения электропроводности.
Значения составляют соответственно 226 и 10 пСм м -1 , и последнее явно неприемлемо.
Показано, как использование конкретной добавки может повысить проводимость ULSD до нескольких сотен пСм м -1 ‘, обеспечивая безопасность продукта с точки зрения электростатического разряда.
Что касается воспламеняемости, температура вспышки дизельного топлива выше 300 ° F или около того. Существует огромная разница между бензином и дизельным топливом с точки зрения опасности сгорания дыма. Электропроводность важна, потому что в топливе с низкой проводимостью электрические заряды могут накапливаться и в конечном итоге привести к рассеянию в виде искры. В последние годы топливо с низкой проводимостью стало причиной ряда пожаров на терминалах нефтепродуктов. В результате были установлены характеристики наименьшей проводимости для определенных операций по обращению с нефтепродуктами.
Стандартное вещество и исследуемое вещество будут испытываться на одном и том же аппарате без изменения условий между испытаниями. Этот подход был использован в описанной работе, в которой шрамы износа измерялись более чем в одном направлении и усреднялись. Такие значения для «стандарта с высоким содержанием масла» и стандарта с низким содержанием масла »при температуре испытания 25 ° C составляли 320 и 654 пм соответственно. Обычное дизельное топливо без обессеривания дало значение 413, в то время как ULSD без добавки давало 613 мкм.Тот же ULSD с добавкой смазывающей способности дал 303 мкм.
ПЛАСТИКОВЫЕ ТОПЛИВОПРОВОДЫ И СТАТИЧЕСКОЕ ЭЛЕКТРИЧЕСТВО
ПЛАСТИКОВЫЕ ТОПЛИВОПРОВОДЫ И СТАТИЧЕСКОЕ ЭЛЕКТРИЧЕСТВО
Мы все согласны с тем, что топливо и статическое электричество могут быть довольно опасными. Статическое электричество — это своего рода электрический заряд, который остается в одном месте — в конце концов, это статических единиц. Это противоположно действующему электричеству, которое перемещается из одного места в другое по определенному пути в цепи.
Статический заряд обычно возникает при трении изоляторов или изолированных проводов.Чтобы избавиться от статического электричества, мы должны превратить его в текущее электричество, создав цепь. Вот что происходит во время удара молнии: в облаке накапливается столько электрического заряда, что воздух между облаком и землей больше не действует как изолятор. И хотя любой, кто играет в гольф лучший в своей жизни, вероятно, не признает этого, молния может быть довольно пугающей. Так могут статические разряды в автомобильной промышленности. Искра рядом с чем-то взрывоопасным — и у вас в руках огненный шар.Все мы знаем о разрушительных и дорогостоящих последствиях обращения с хрупкой электроникой после прогулки по ковру. Здесь требуются антистатические продукты, такие как токопроводящий шланг, как описано ниже.
Есть два способа предотвратить накопление статического электричества в шланге: физическими методами или химическими средствами. Для шлангов это может означать, что через них пропущена проволока с высокой проводимостью или, что более часто, добавляются добавки к вкладышу трубки, которые помогают проводить и рассеивать статический заряд.Последний подход используется компанией Racetronix при создании шланга Teflon ™ серии TFT1170.
Важно знать, почему статическое электричество особенно проблемно с пластиками, такими как тефлон. Электропроводность тефлона экспоненциально ниже, чем у силикона и даже резины, поэтому мы не видим такого же антистатического акцента на силиконовых и резиновых шлангах. Антистатический шланг, предлагаемый Racetronix, незаменим в тех случаях, когда среда, проходящая через шланг, имеет низкую проводимость. Особенно проблематичны топливо, растворители и фреон.Важно отметить, что антистатическая подкладка не только предотвращает «БУМ!», Но и помогает продлить срок службы шланга. При использовании жидкостей с низкой проводимостью и высокой скоростью в непроводящем шланге быстро накапливается статический заряд. Затем этот заряд пытается «переместиться» на землю, образовывая дугу от внутренней оболочки к проволочной оплетке. Это приводит к образованию крошечных отверстий в тефлоновых вкладышах шлангов общего назначения. В заводских топливных системах последних моделей используется комбинация проводящего пластика и заземляющих проводов в баке и насосных модулях для рассеивания статического электричества.Применение проводящих антистатических покрытий в автомобильной промышленности может принести большую пользу. Незначительно более высокая стоимость шланга быстро компенсируется более длительным сроком службы и повышенной безопасностью.
В заключение, при выборе шланга для нового применения важно учитывать не только текучесть и химическую совместимость потенциальных шлангов, но также и электрические свойства. При работе с жидкостями с высокой скоростью потока и низкой проводимостью, пожалуйста, обратите внимание на шланги серии Racetronix TFT1170 с проводящей футеровкой и тефлоновой оплеткой.
Цифровой измеритель проводимости модели 1152: Emcee Electronics
(Стандартный метод испытаний ASTMS D 2624 включен в спецификации D975, D1655 и D7566)
- Непрерывный стандартный диапазон электропроводности от 1 до 2000 с шагом 1 пикосимен на метр (пСм / м)
- Доступны другие стандартные и нестандартные диапазоны проводимости до 20M pS / m
- Большой цифровой жидкокристаллический дисплей
- Надежная передовая технология проектирования интегральных схем
- Самопроверка калибровки с возможностью настройки в полевых условиях
- Автоматическая индикация выхода за пределы допустимого диапазона и низкого заряда батареи
- Возможность измерения резервуаров и автоцистерн с использованием короткого кабеля или комплекта кабельной катушки
- Работает от 3-х доступных щелочных батареек
- Электроника размещена в прочном литом алюминиевом корпусе, покрытом стойкой к растворителям краской, оснащена съемным датчиком из нержавеющей стали.
- Искробезопасная конструкция, одобренная для использования в опасных средах лабораторией Underwriters Laboratories (UL) U.S, (UL) Канада и LCIE (Европа)
Приложения
Цифровой кондуктометр модели 1152 обеспечивает измерение электропроводности жидкостей в единицах электропроводности (CU), которые определены как пикосименс на метр в стандарте ASTM D2624. Прочная электромеханическая конструкция расходомера модели 1152 упрощает использование как в лабораторных, так и в полевых условиях. Изначально измеритель был разработан и разработан из соображений безопасности для измерения электропроводности углеводородного топлива, особенно реактивного топлива.Впоследствии измеритель был модифицирован с другими диапазонами проводимости, чтобы обеспечить возможность измерения различных жидкостей для использования во многих различных приложениях.
Безопасность
Углеводородное топливо обычно имеет низкую электропроводность и, следовательно, чувствительно к сохранению статического заряда. Возникают статические заряды, особенно когда топливо перекачивается через фильтры с высокой скоростью. Из-за относительно низкой проводимости статический заряд не рассеивается быстро и сохраняется в течение значительного периода времени.Это может привести к взрыву и / или возгоранию. Поскольку проводимость может изменяться в зависимости от температуры, важно записать температуру топлива, при которой проводились измерения.
Управление процессами
В дополнение к соображениям безопасности, электропроводность жидкостей может контролироваться для управления технологическим процессом. Правильное добавление и смешивание различных ингредиентов можно контролировать на разных этапах производства. Эти приложения не ограничиваются углеводородами, но были расширены и на другие продукты; например, краски, растворители, чернила и другие неорганические предметы.Зонд из нержавеющей стали относительно невосприимчив к воздействию большинства кислотных и едких растворов.
Теория работы
Измеритель EMCEE модели 1152 состоит из электронного блока и съемного зонда из нержавеющей стали. Зонд, который похож на конденсатор с концентрическими электродами, погружается в жидкость до набора отверстий рядом с электронным узлом. Нажатие кнопки «M» вызывает прохождение относительно небольшого постоянного тока через жидкость между электродами.Ток усиливается в электронном блоке и отображается на жидкокристаллическом дисплее в пикосименсах на метр (пСм / м).
Что такое этанол E85? | YourMechanic Advice
Этанол E85 — это топливо, которое можно использовать для двигателей внутреннего сгорания. Некоторые автомобили могут использовать E85 и бензин, в то время как другие настроены только на E85. E85 назван так, потому что это 85% алкоголя. Остальные 15% — это бензин или другие жидкости, используемые для заполнения объема. Спирт, используемый в E85, доступен из множества источников, поэтому его легко производить в любой точке мира.
Зачем использовать этанол E85?
В регионах, где трудно или невозможно импортировать достаточное количество бензина, этанол E85 является единственным жизнеспособным решением в качестве топлива. E85 может быть изготовлен из различных материалов, включая сахарный тростник, кукурузу и целлюлозные отходы (в изобилии в районах, где много сельского хозяйства). Есть и другие преимущества E85 перед обычным бензином:
E85 имеет более высокое октановое число, чем бензин, поэтому его можно использовать с двигателями с более высокой степенью сжатия.В частности, автомобили, которые используют принудительную индукцию, могут получить значительный прирост мощности от E85.
E85 выделяет меньше CO2 в выхлопных газах.
E85 может производиться более экологически рационально, чем бензин.
Автомобили с гибким топливом могут использовать как E85, так и бензин, что делает их более универсальными, чем обычные автомобили.
Автомобили E85
Транспортные средства, которые используют этанол E85 в качестве топлива, либо настроены специально для использования с этанолом, либо являются автомобилями с гибким топливом.Транспортные средства Flex Fuel могут использовать любое топливо, так как их двигатели могут настраиваться для оптимизации трансмиссии для любого топлива. Автомобили, работающие только на бензине, нуждаются в разных частях топливной системы и разных настройках, чтобы иметь возможность использовать E85. Поскольку E85 токопроводящий, в отличие от бензина, он может вызвать проблемы с топливным насосом. Некоторые металлы также могут подвергаться коррозии при контакте с этанолом.
E85 противоречие
Несмотря на то, что у E85 есть множество преимуществ, некоторые разногласия возникли в связи с его растущей популярностью в США.В США этанол E85 в основном производится из кукурузы. Кукуруза также используется в ряде пищевых продуктов. Противники E85 не согласны с использованием потенциальной пищи для производства топлива.
Кроме того, хотя E85 действительно производит меньше CO2, чем обычный газ, он производит больше других парниковых газов. Его часто рекламируют как более экологичную альтернативу бензину, но некоторые оспаривают этот факт.
E85 — это жизнеспособное топливо, и по мере того, как оно становится все более и более экологичным по сравнению с бензином, его популярность будет расти.
Проводящая керамика | Британника
Электропроводящая керамика , современные промышленные материалы, которые благодаря изменениям в своей структуре служат электрическими проводниками.
Помимо хорошо известных физических свойств керамических материалов — твердости, прочности на сжатие, хрупкости — существует свойство удельного электрического сопротивления. Большая часть керамики сопротивляется прохождению электрического тока, и по этой причине керамические материалы, такие как фарфор, традиционно использовались в качестве электрических изоляторов.Однако некоторая керамика отлично проводит электричество. Большинство этих проводников — это современная керамика, современные материалы, свойства которых изменяются за счет точного контроля над их производством из порошков в изделия. Свойства и производство современной керамики описаны в статье «Современная керамика». В этой статье предлагается обзор свойств и областей применения некоторых электропроводящих современных керамических материалов.
Причины возникновения удельного сопротивления в большинстве керамических материалов описаны в статье «Состав и свойства керамики».Для целей этой статьи можно кратко объяснить происхождение проводимости в керамике. Электропроводность в керамике, как и в большинстве материалов, бывает двух типов: электронная и ионная. Электронная проводимость — это прохождение свободных электронов через материал. В керамике ионные связи, удерживающие атомы вместе, не допускают свободных электронов. Однако в некоторых случаях в материал могут быть включены примеси разной валентности (то есть имеющие разное количество связывающих электронов), и эти примеси могут действовать как доноры или акцепторы электронов.В других случаях могут быть включены переходные металлы или редкоземельные элементы различной валентности; эти примеси могут действовать как центры для поляронов — разновидностей электронов, которые создают небольшие области локальной поляризации при перемещении от атома к атому. Электропроводящая керамика используется в качестве резисторов, электродов и нагревательных элементов.
Ионная проводимость состоит из перехода ионов (атомов с положительным или отрицательным зарядом) от одного узла к другому через точечные дефекты, называемые вакансиями в кристаллической решетке.При нормальных температурах окружающей среды происходит очень мало прыжков ионов, поскольку атомы находятся в относительно низкоэнергетических состояниях. Однако при высоких температурах вакансии становятся подвижными, и некоторые керамические материалы демонстрируют так называемую быструю ионную проводимость. Эта керамика особенно полезна в датчиках газа, топливных элементах и батареях.
Получите подписку Britannica Premium и получите доступ к эксклюзивному контенту. Подпишись сейчасТолстопленочные и тонкопленочные резисторы и электроды
Полиметаллические керамические проводники имеют самую высокую проводимость среди всех керамик, кроме сверхпроводящей (описанной ниже).Примерами полуметаллической керамики являются оксид свинца (PbO), диоксид рутения (RuO 2 ), рутенат висмута (Bi 2 Ru 2 O 7 ) и иридат висмута (Bi 2 Ir 2 O 7 ). Как и металлы, эти материалы имеют перекрывающиеся энергетические зоны электронов и, следовательно, являются отличными электронными проводниками. Они используются как «чернила» для резисторов трафаретной печати в толстопленочных микросхемах. Чернила представляют собой измельченные частицы проводника и глазури, диспергированные в подходящих органических веществах, которые придают свойства текучести, необходимые для трафаретной печати.При обжиге органика выгорает, а глазури плавятся. Изменяя количество частиц проводника, можно добиться больших вариаций сопротивления толстых пленок.
Керамика на основе смесей оксида индия (In 2 O 3 ) и оксида олова (SnO 2 ), называемая в электронной промышленности оксидом индия и олова (ITO), — выдающиеся электронные проводники, и у них есть дополнительное преимущество оптической прозрачности. Проводимость и прозрачность возникают из-за комбинации большой запрещенной зоны и включения достаточного количества доноров электронов.Таким образом, существует оптимальная концентрация электронов, чтобы максимизировать как электронную проводимость, так и оптическую передачу. ITO видит широкое применение в качестве тонких прозрачных электродов для солнечных элементов и жидкокристаллических дисплеев, например, используемых в экранах портативных компьютеров. ITO также используется в качестве тонкопленочного резистора в интегральных схемах. Для этих целей он применяется стандартными методами тонкопленочного осаждения и фотолитографии.
Проводящая керамика уже давно используется в качестве нагревательных элементов для электрических нагревателей и печей с электрическим нагревом.Проводящая керамика особенно эффективна при повышенных температурах и в окислительных средах, где устойчивые к окислению металлические сплавы не работают. Примеры электродной керамики и их максимальной температуры использования на воздухе показаны в таблице 1. Каждый материал имеет уникальный механизм проводимости. Карбид кремния (SiC) обычно является полупроводником; однако, легированный соответствующим образом, он является хорошим проводником. Как SiC, так и дисилицид молибдена (MoSi 2 ) образуют защитные поверхностные слои из кварцевого стекла, которые защищают их от окисления в окислительной атмосфере.MoSi 2 — полуметалл с высокой проводимостью. Хромит лантана (LaCr 2 O 4 ) — небольшой поляронный проводник; замена ионов щелочноземельных металлов (, например, кальция или Ca 2+ ) на La 3+ приводит к превращению равной доли Cr 3+ в Cr 4+ . Перескок электронов между двумя состояниями ионов Cr обеспечивает высокую проводимость, особенно при повышенных температурах.
| керамический материал | максимальная температура использования на воздухе | |
|---|---|---|
| общее название | химическая формула | (° C / ° F) |
| карбид кремния | SiC | 1,500 / 2,730 |
| дисилицид молибдена | MoSi 2 | 1,800 / 3,270 |
| хромит лантана | LaCr 2 O 4 | 1,800 / 3,270 |
| диоксид циркония | ZrO 2 | 2,200 / 3,630 |
Проводимость в диоксиде циркония (ZrO 2 ) является ионной, в отличие от механизмов электронной проводимости, описанных выше.При легировании диоксида циркония ионами Ca 2+ или иттрия (Y 3+ ) образуются кислородные вакансии. При температуре выше 600 ° C (1100 ° F) ионы кислорода (O 2-) становятся подвижными и заполняют эти вакансии, и они очень подвижны при более высоких температурах. Для нагревательных элементов из диоксида циркония требуется предварительный нагреватель для достижения порога 600 ° C, но их можно использовать для достижения температуры до 2000 ° C (3600 ° F).
Оксид олова (SnO 2 ) имеет очень специфическое применение в качестве предпочтительного электрода для специальных стекловаренных печей (как для оптического стекла).Это приложение требует высокой проводимости и устойчивости к коррозионным элементам в расплаве стекла; кроме того, корродированный электродный материал не должен изменять цвет стекла. Оксид олова — единственный материал, который удовлетворяет этим критериям. Чистый оксид олова — это полупроводник с широкой запрещенной зоной, но присущий ему недостаток кислорода плюс замена олова ионами сурьмы приводит к высокой проводимости.
Инновации для измерения проводимости авиационного топлива Petro Online
Электропроводность — важный параметр для безопасного и экономичного обращения с топливом, которое может накапливать статический заряд.
Авиационное топливо высокой степени очистки с очень низкой проводимостью. Чтобы обеспечить безопасное хранение и распределение топлива, авиакомпании и регулирующие органы установили ASTM D2624 для электропроводности авиационного и дистиллятного топлива и ASTM D1655 для определения допустимых уровней проводимости топлива. Добавка, рассеивающая статическое электричество (SDA), или присадка, улучшающая проводимость, часто добавляется в топливо для достижения заданных уровней. Электрический заряд топлива рассеивается на стенках резервуара для хранения или трубопровода, тем самым снижая вероятность возникновения искры.
Традиционные измерения электропроводности топлива основаны на использовании электрических датчиков постоянного тока (DC), которые имеют значительные ограничения. Измерение постоянного напряжения требует, чтобы образец топлива был абсолютно неподвижным, зависел от времени и температуры, что снижает точность и воспроизводимость. Кроме того, датчики постоянного тока нельзя использовать для измерения электропроводности топлива, непосредственно протекающего по трубопроводам.
SETA D-2 Technology от Stanhope Seta (Великобритания) выпустила серию новых портативных датчиков электропроводности топлива переменного тока , которые предлагают авиационной промышленности совершенно новое измерение в управлении проводимостью топлива в соответствии с ASTM D2624.Технология датчика переменного тока не требует, чтобы образец топлива был статическим, а измерения не столь чувствительны к температуре. Это обеспечивает улучшенную повторяемость и воспроизводимость с меньшим количеством ошибок измерения, датчики также легко калибруются в полевых условиях. Примечательно, что эта технология также обеспечивает надежные измерения электропроводности трубопроводов в режиме реального времени.
Встроенный датчик проводимости SETA D-2 обеспечивает измерение в реальном времени в линейке продуктов с возможностью круглосуточной записи, которая может быть напрямую интегрирована с системами управления топливом.Прямое измерение проводимости на входе позволяет контролировать качество поступающего топлива до того, как произойдет впрыск присадки, что значительно снижает риск недостаточного или избыточного впрыска и дает возможность значительной экономии средств.
Встроенный датчик подходит для длительного погружения в топливо. Он легко устанавливается и снимается с трубопровода с помощью выдвижной опоры, которая работает через полнопроходной шаровой кран из нержавеющей стали. Датчик является взрывозащищенным и искробезопасным по классу ATEX / FM / FMc для работы по 2-проводной петле (4-20 мА) во взрывоопасных зонах, доступна версия для высокого давления.
Измерение проводимости на линииявляется нервным центром систем прецизионного впрыска D2 , систем управления технологическим процессом , установленных на салазках, которые контролируют и контролируют чистую присадку, поскольку она смешивается непосредственно с потоком топлива, устраняя необходимость смешивать присадки перед впрыском и предотвращая возможность неправильные объемы добавок.
www.stanhope-seta.co.uk
Опасности при нагрузке на коммутатор— Armstrong Forensic Laboratory, Inc.
«Нагрузка на коммутатор»: отвечает за до 80% взрывов, вызванных статическим электричеством.
В это время года, когда воздух становится все холоднее и суше, мы часто заново знакомимся с раздражение статического электричества.Когда мы идем по ковру в носках, мы можем генерировать статический заряд, который вызывает у нас удивительный «шок», когда мы хватаемся за дверную ручку или обнимаем любимого человека. Но статические заряды также могут вызвать разрушительные пожары и взрывы, когда искра возникает во взрывоопасной среде.
Некоторые люди могут быть удивлены, узнав, что жидкости, протекающие по трубам, также могут генерировать статические заряды. Это особенно важно для непроводящих жидкостей, таких как топливо и другие нефтепродукты. Статические заряды возникают из-за потока и движения непроводящей жидкости, когда она вступает в контакт с другими материалами, такими как трубы, насосы, фильтры и т. Д.
Армстронг недавно расследовал взрыв автоцистерны, произошедший в результате «погрузки стрелы». Загрузка переключателя — это процесс загрузки дизельного топлива в бак, в котором ранее находился бензин, но все еще содержались пары бензина. Согласно ASTM, 80% взрывов, инициированных статическим электричеством, приходится на нагрузку переключателя или заполнение брызгами (или и то и другое).
Прицепы бензовозов обычно содержат несколько отдельных отсеков для перевозки топлива. Обычно топливные баки с бензином «слишком богатые» для воспламенения, а баки с дизельным топливом «слишком бедные» для воспламенения.Но в промежуточном сценарии, например, во время загрузки переключателя, можно создать взрывоопасную среду в резервуаре, где концентрация топлива в воздухе находится между нижним пределом взрываемости (LEL) и верхним пределом взрываемости (UEL) для система. Когда внутри бака возникает статический разряд, искра может воспламенить топливо с разрушительными последствиями.
Обычно предпринимаются многочисленные меры предосторожности, чтобы минимизировать образование статических разрядов при заполнении топливного бака, такие как минимизация разбрызгивания, ограничение скорости потока и обеспечение адекватного «времени релаксации» заряда после прохождения через фильтр.Для получения дополнительной информации обратитесь к стандарту, опубликованному ASTM: D4865 — Стандартное руководство по генерации и рассеиванию статического электричества в нефтяных топливных системах.
 Бензин диэлектрик. Электропроводность бензина составляет не более 450 пикоСм/м,
Бензин диэлектрик. Электропроводность бензина составляет не более 450 пикоСм/м, Установленные на автомобилях с системой подачи топлива электробензонасосы, например производства BOSCH, находятся в бензобаке и омываются бензином.
Установленные на автомобилях с системой подачи топлива электробензонасосы, например производства BOSCH, находятся в бензобаке и омываются бензином. Действительно, хорошо известно, что в КЩМ электродвигателя может возникать интенсивное искрение. Это может стать причиной взрыва бензобака, когда он пустой, а концентрация паров бензина соответствующая. Однако фирма BOSCH выпускает погружные электробензонасосы более 30 лет и случаев взрывов бензобака не зарегистри-ровано.
Действительно, хорошо известно, что в КЩМ электродвигателя может возникать интенсивное искрение. Это может стать причиной взрыва бензобака, когда он пустой, а концентрация паров бензина соответствующая. Однако фирма BOSCH выпускает погружные электробензонасосы более 30 лет и случаев взрывов бензобака не зарегистри-ровано.
 Юткин Л.А. Электрогидравлический эффект и его применение в промышленности.Л.: Машиностроение, Ленингр. отд-ние, 1986. — 253 с, ил.
Юткин Л.А. Электрогидравлический эффект и его применение в промышленности.Л.: Машиностроение, Ленингр. отд-ние, 1986. — 253 с, ил.
 Заземляются и цистерны, наливные суда, прочие технические средства, где происходит слив и налив топлива. При этом электросопротивление контуров заземления устройств и контуров не превышает 100 Ом.
Заземляются и цистерны, наливные суда, прочие технические средства, где происходит слив и налив топлива. При этом электросопротивление контуров заземления устройств и контуров не превышает 100 Ом. [4]
[4]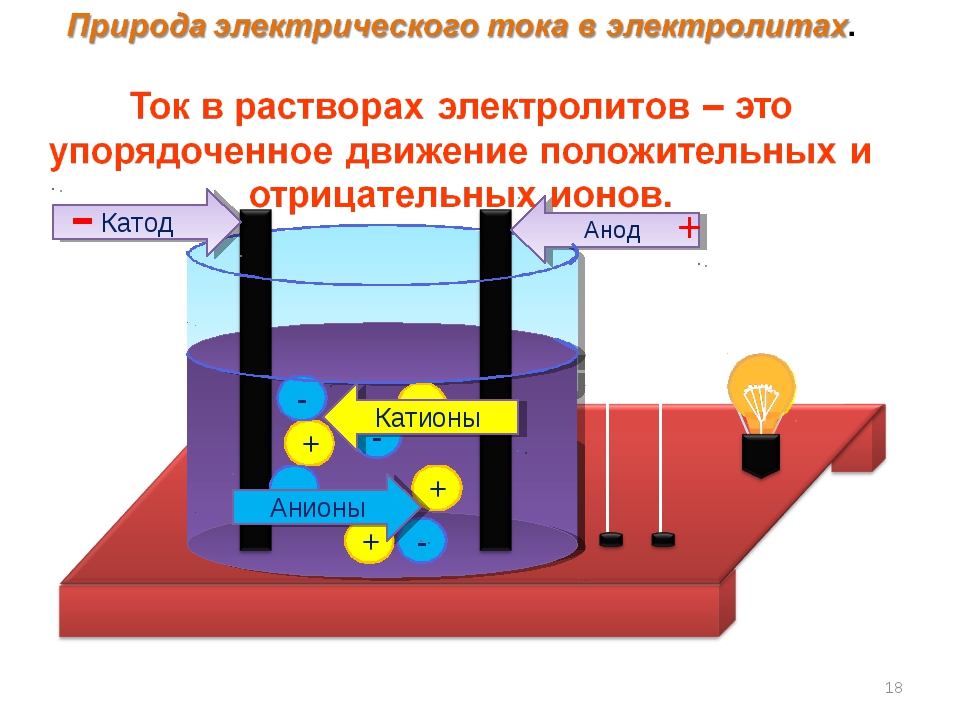 Рлектропроводность углеводородных топлив может увеличиваться РїСЂРё добавлении РјРЅРѕРіРёС… соединений ( табл. 59), однако РЅРµ РІСЃРµ РѕРЅРё применимы РІ качестве антистатических присадок РёР·-Р·Р° несоответствия РґСЂСѓРіРёС… свойств требованиям эксплуатации. [8]
Рлектропроводность углеводородных топлив может увеличиваться РїСЂРё добавлении РјРЅРѕРіРёС… соединений ( табл. 59), однако РЅРµ РІСЃРµ РѕРЅРё применимы РІ качестве антистатических присадок РёР·-Р·Р° несоответствия РґСЂСѓРіРёС… свойств требованиям эксплуатации. [8] РіР». [12]
РіР». [12] ).
). Разряд электричества обычно происходит на острых гранях, выступах, в том числе на выступах различных датчиков верхней части баков емкостей и резервуаров, в которых хранится топливо. Разряды накопленного электричества могут быть двух типов: коронного и искрового. Большинство разрядов коронного типа. Они менее опасны и лишь способствуют ослаблению напряженности поля. Опасны искровые разряды, обладающие большой энергией.
Разряд электричества обычно происходит на острых гранях, выступах, в том числе на выступах различных датчиков верхней части баков емкостей и резервуаров, в которых хранится топливо. Разряды накопленного электричества могут быть двух типов: коронного и искрового. Большинство разрядов коронного типа. Они менее опасны и лишь способствуют ослаблению напряженности поля. Опасны искровые разряды, обладающие большой энергией. Так, исследовано изменение проводимости дизельного топлива, метилдодецена и додецил бензол а в условиях поглощения ими кислорода (искусственного старения). Поглощение кислорода фиксировалось не только количественно, но и путем определения функциональных групп продуктов окисления: кислот, карбонильных и гидроксильных соединений. Из данных табл. 59 видно, что с увеличением количества поглощенного кислорода (окисление велось при 110°С в присутствии меди) проводимость топлив и углеводородов заметно возрастает.
Так, исследовано изменение проводимости дизельного топлива, метилдодецена и додецил бензол а в условиях поглощения ими кислорода (искусственного старения). Поглощение кислорода фиксировалось не только количественно, но и путем определения функциональных групп продуктов окисления: кислот, карбонильных и гидроксильных соединений. Из данных табл. 59 видно, что с увеличением количества поглощенного кислорода (окисление велось при 110°С в присутствии меди) проводимость топлив и углеводородов заметно возрастает. На кривой видны характерные «сбросы», свидетельствующие о происходящих разрядах и, следовательно, о частичной релаксации |скопившегося статического электричества.
На кривой видны характерные «сбросы», свидетельствующие о происходящих разрядах и, следовательно, о частичной релаксации |скопившегося статического электричества. С перемещением топлива перемещается слой ионов одного заряда вдоль слоя ионов противоположного заряда, адсорбированного на стенке трубы. Возникает электрический заряд, перемещающийся и накапливающийся в емкости, куда перекачивается топливо. В обводненном топливе скапливающийся электрический заряд выше, чем в сухом. Присутствие влаги приводит к увеличению поверхности раздела фаз в углеводородной среде. Резким увеличением поверхности объясняется повышенная электризация топлива при фильтрации. Так, при фильтрации топлива через фильтр сверхтонкой очистки заряд в баке возрастал в 10— 200 раз.
С перемещением топлива перемещается слой ионов одного заряда вдоль слоя ионов противоположного заряда, адсорбированного на стенке трубы. Возникает электрический заряд, перемещающийся и накапливающийся в емкости, куда перекачивается топливо. В обводненном топливе скапливающийся электрический заряд выше, чем в сухом. Присутствие влаги приводит к увеличению поверхности раздела фаз в углеводородной среде. Резким увеличением поверхности объясняется повышенная электризация топлива при фильтрации. Так, при фильтрации топлива через фильтр сверхтонкой очистки заряд в баке возрастал в 10— 200 раз. Только в этом случае происходит достаточно быстрая релаксация заряда скапливающегося статического электричества. При проводимости ниже 50•10-14•ом-1 •см-1 электрический заряд рассеивается недостаточно быстро; поэтому он может скапливаться и достигать опасной величины. При проводимости топлива 10-11—10-12 ом-1 • см-1 релаксация заряда происходит почти мгновенно.
Только в этом случае происходит достаточно быстрая релаксация заряда скапливающегося статического электричества. При проводимости ниже 50•10-14•ом-1 •см-1 электрический заряд рассеивается недостаточно быстро; поэтому он может скапливаться и достигать опасной величины. При проводимости топлива 10-11—10-12 ом-1 • см-1 релаксация заряда происходит почти мгновенно. С увеличением концентрации присадки в топливе величина удельной проводимости его растет.
С увеличением концентрации присадки в топливе величина удельной проводимости его растет. Топливо следует закачивать »в емкости с минимальной скоростью до тех пор, пока патрубок не будет полностью погружен в жидкость. Нужно избегать перемешивания топлива воздухом, паром, газом, механическими средствами (струйные сопла, рециркуляция и др.) В отдельные отсеки танкера топливо следует закачивать со скоростью не более 0,9 м/сек. Опасность пожара и взрыва становится особенно велика, когда топливо заливают при температуре выше температуры его вспышки.
Топливо следует закачивать »в емкости с минимальной скоростью до тех пор, пока патрубок не будет полностью погружен в жидкость. Нужно избегать перемешивания топлива воздухом, паром, газом, механическими средствами (струйные сопла, рециркуляция и др.) В отдельные отсеки танкера топливо следует закачивать со скоростью не более 0,9 м/сек. Опасность пожара и взрыва становится особенно велика, когда топливо заливают при температуре выше температуры его вспышки.